- Автор: Super User
- Опубліковано: 14 липня 2019
- Перегляди: 3421
УДК 617.735–0021:616.379–008.6:611.018.74:616–008.6–07:001.8
https://doi.org/10.30702/Ophthalmology.2019/09.072033
Сук С. А.1, 2, Риков С. О.1, Кирилюк М. Л.3
1Національна медична академія післядипломної освіти імені П. Л. Шупика, м. Київ, Україна
2Київська міська клінічна офтальмологічна лікарня, м. Київ, Україна
3Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України, м. Київ, Україна
Резюме. Робота присвячена вивченню особливостей вмісту фракталкіну в сироватці крові в пацієнтів із цукровим діабетом (ЦД) 2-го типу у взаємозв’язку з інструментальними показниками стану шарів макули при різних формах діабетичного макулярного набряку (ДМН). Дослідження проведені у 82 хворих із ЦД 2-го типу (145 очей), розділених на 4 групи відповідно до форми ДМН. За допомогою однофакторного дисперсійного та регресійного аналізу, методики побудови логістичних моделей регресії показано, що у хворих із ЦД 2-го типу вірогідно зменшуються шанси наявності високого значення area thickness на кожний 1 нг/мл. Пороговим значенням вмісту фракталкіну сироватки крові для високого значення (≥ 354 мкн) area thickness визначено ≤ 1,632 нг/мл при чутливості тесту 42,9 % і специфічності 88,4 %. Зроблено висновок щодо протекторної ролі фракталкіну в розвитку ДМН та його терапевтичного потенціалу щодо зменшення патогенного впливу ЦД 2-го типу на нейросудинну одиницю сітківки ока.
Ключові слова: фракталкін, діабетичний макулярний набряк, цукровий діабет 2-го типу.
ВСТУП
Хронічна гіперглікемія зумовлює виникнення мікро- та макросудинних ускладнень у багатьох органах і тканинах в організмі. За пошкодження, спричинені гіперглікемією, відповідають чотири основні ланки патогенезу: підвищена активність поліолового та гексозамінового шляху, активація протеїнкінази С і накопичення кінцевих продуктів глікації. Ці шляхи метаболізму активізуються збільшеним рівнем різних метаболітів глюкози в межах гліколізного шляху [1]. Підвищена активність кожного з цих шляхів зумовлює зростання клітинного оксидативного стресу і, як наслідок, ініціацію індукованого хронічною гіперглікемією запалення через збільшення продукції низки гормонів, системних і локальних медіаторів запалення, таких як цитокіни (хемокіни) та молекули адгезії, а також підвищення активності мікроглії [2–4]. Кожен з цих шляхів пов’язаний з патогенезом діабетичної ретинопатії (ДРП) та діабетичного макулярного набряку (ДМН) [2]. При цьому ДМН може виникати в разі будь-якої ДРП [5]. Системні й локальні запальні ускладнення, сприяючи ушкодженню сітківки ока, можуть призводити до виникнення різних ефектів [6]. Так, системні прозапальні цитокіни зазвичай мають низьку активність і виробляються вісцеральною жировою тканиною та макрофагами, які проникають у жирову тканину в стані резистентності до інсуліну при ожирінні та ЦД 2-го типу [8–11]. Навпаки, локальні прозапальні цитокіни утворюються пігментним епітелієм сітківки та гліальними клітинами [6].
Ефекти запалення нервових компонентів сітківки можуть бути виявлені на ранніх стадіях ДМН [12–15]. Ключовими змінами є мікрогліальна активація та дисфункція клітин Мюллера. Ці ефекти, зокрема, призводять до порушення метаболізму глютамату в глії, змін контактів між глією та судинами, а також до загибелі нейронів та гангліїв [13, 14]. Проліферуюча мікроглія поширюється по всій ділянці сітківки та субретинального простору [16]. Загибель гангліонарних клітин та аксональна атрофія є ознаками дисфункції невральних компонентів при ДМН [17]. Можна сказати, що завдяки особливостям анатомічної будови сітківки ока неспецифічні запальні процеси, пов’язані з діабетом, досягають вищої точки саме в очному дні [18].
Одним із важливих сучасних хемокінів, що беруть участь у нормальному функціонуванні нейросудинної одиниці ока, є фракталкін (CX3CL1) та його рецептор CX3CR1. Це трансмембранний білок з хемокіновим доменом, прикріпленим до довгого муциноподібного стебла [19]. Уперше фракталкін (інша назва нейротактин) був описаний колективом авторів у 1997 році [20–22]. Фракталкін експресується на мембранах здорових нейронів [23], у сітківці він секретується гангліонарними клітинами ретини (RGC). Джерелом фракталкіну поза нервовою системою є ендотелій, а також жирова тканина. Його ще називають новим адипохемокіном, асоційованим із ЦД 2-го типу [24].
Згідно з останніми даними «Атласу генетики і цитогенетики в онкології та гематології» [25] фракталкін має безпосереднє відношення до таких морфологічних (структурних) компонентів і процесів в організмі, як: інтегральний компонент плазматичної мембрани; опосередкований хемокінами сигнальний шлях; хемотаксис макрофагів; активність рецепторів хемокінів; імунна відповідь; пов’язаний G-білком рецепторний сигнальний шлях; клітинна відповідь на трансформуючий фактор росту бета (TGF-β); клітинна адгезія; нуклеоплазма; реакція клітинного захисту; протекція нейронів; активація мікрогліальних клітин тощо.
Наявні відомості про роль фракталкіну в патогенезі різних захворювань дозволяють розглядати CX3CL1 і його рецептор CX3CR1 не тільки як маркер активації запалення і адгезії, а як певний регулятор активності проліферації, наприклад, фібробластів, м’язових волокон, злоякісних клітин, нейронів і гліальних клітин [26–28]. Останнім часом у деяких дослідженнях на культурах гладком’язових клітин продемонстровано, що CX3CL1 володіє антиапоптотичними властивостями [29]. Показано, що дефіцит CX3CR1 зумовлює дегенерацію судин і прискорює розвиток ретинопатії при довгостроковому ЦД (на моделі ЦД 1-го типу в гризунів) [30]. За відсутності CX3CR1 дисрегульовані мікрогліальні відповіді сприяють опосередкованому запаленням пошкодженню нейронів у діабетичній сітківці [31, 32]. Вищевикладене свідчить про те, що дослідження нових патогенетичних механізмів розвитку ДМН із залученням гліальних компонентів сітківки є актуальним питанням клінічної офтальмології.
МЕТА
Проаналізувати вміст фракталкіну в сироватці крові в пацієнтів із ЦД 2-го типу у взаємозв’язку з інструментальними показниками стану шарів макули при різних формах діабетичного макулярного набряку.
МАТЕРІАЛИ ТА МЕТОДИ ДОСЛІДЖЕННЯ
Дослідження проведені у 82 пацієнтів із ЦД 2-го типу (145 очей), розділених на 4 групи відповідно до форми ДМН. Середній вік пацієнтів становив 65,25 ± 10,85 року, середня тривалість ЦД від встановлення діагнозу – 14,0 ± 7,05 року. Середній рівень глікованого гемоглобіну (HbA1с) був 8,40 ± 1,58 %. Форму ДМН визначали за класифікацією Американської академії офтальмології [33]. Відповідно до класифікації ми розподілили хворих з ДМН на 4 групи: 0 – ДМН відсутній, 1 – ДМН легкого ступеня, 2 – ДМН помірного ступеня, 3 – ДМН тяжкого ступеня. Усім пацієнтам було проведено лабораторне (HbA1с, фракталкін крові) та комплексне офтальмологічне обстеження. Критеріями включення у відкрите дослідження були добровільна інформована згода, вік понад 18 років, наявність ЦД 2-го типу. Критеріями невключення – наявність ендокринних захворювань, що призводять до ЦД 2-го типу (синдром Кушинга, диспітуїтаризм, синдром полікістозних яєчників, спадкові ендокринопатії), ЦД 1-го типу, гострі інфекційні захворювання, онкологічні захворювання (у т. ч. в анамнезі), декомпенсація коморбідної патології, психічні розлади, приймання нейролептиків, антидепресантів, наявність нейродегенеративних захворювань ЦНС (хвороба Альцгеймера, розсіяний склероз тощо), протеїнурії, пошкодження зорового нерва, глаукома та зріла катаракта. Концентрацію фракталкіну в сироватці крові визначали методом імуноферментного аналізу (ІФА) за допомогою набору для кількісного визначення фракталкіну людини RayBio® Human Fractalkine ELISA Kit Protocol фірми Ray Biotech, Inc (США) з використанням аналізатора IEMS Reader MF (Labsystems, Фінляндія). Офтальмологічне обстеження включало: візометрію, периметрію, тонометрію, рефрактометрію, біомікроскопію, гоніоскопію, офтальмоскопію, оптичну когерентну томографію з ангіографією, фундусскопію (з фотографуванням очного дна). Для аналізу були використані такі інструментальні показники: товщина шару нервових волокон (nerve fbre layer – NFL), шару гангліонарних клітин (ganglion cell layer – GCL), внутрішнього граничного шару (inner posterior layer – IPL), центральної товщини сітківки (central sector), об’єму макули (volume macula) та центральної ямки (volume fovea), мінімальної товщини центральної ямки (minimum in fovea), середньої товщини макули (area thickness). Статистичний аналіз результатів дослідження здійснювався за допомогою пакету статистичного програмного забезпечення MedCalc v. 18.11 (MedCalc Software Inc, Broekstraat, Бельгія), включав однофакторний дисперсійний і регресійний аналіз. Аналіз результатів дослідження проводили з використанням статистичного пакета EZR v. 1.35 (Saitama Medical Center, Jichi Medical University, Saitama, Японія), що представляє графічний інтерфейс до R (The R Foundation for Statistical Computing, Vienna, Австрія).
Під час проведення статистичного аналізу використано однофакторний дисперсійний аналіз (критерій Крускала – Уолліса), метод побудови логістичних моделей регресії. Адекватність моделей регресії оцінювали за методом побудови кривої операційних характеристик (Receiver Operating Characteristic curve – ROC-кривої) за площею під кривою (Area Under the Curve – AUC), розраховували 95 % довірчий інтервал (ДІ) показників. Ступінь і напрямок зв’язку факторних і результуючої ознак оцінювали за показником відношення шансів (ВШ) із 95 % ДІ. Оптимальне значення критичного порогу для логістичних моделей регресії розраховували з використанням показника Youden index J. Прогностичні характеристики логістичної моделі регресії оцінювали за її чутливістю, специфічністю, прогностичністю позитивного (ППЗ) та негативного значення (ПНЗ) із відповідним 95 % ДІ [34–36]. Критичний рівень статистичної значущості відмінностей було прийнято за p < 0,05.
ОТРИМАНІ РЕЗУЛЬТАТИ
Уміст фракталкіну в сироватці крові хворих із ЦД 2-го типу при різних формах ДМН представлено нижче (таблиця 1).
Таблиця 1. Уміст фракталкіну в сироватці крові хворих із ЦД 2-го типу при різних формах ДМН
| Показник | Ме (QI–QIII) [Min; Max] |
Рівень значущості відмінності, p |
|||
|
ДМН 0 (n = 12) |
ДМН 1 (n = 18) |
ДМН 2 (n = 25) |
ДМН 3 (n = 27) |
||
| Фракталкін, нг/мл |
1,792 (1,738–1,931) |
1,903 (1,685–2,018) |
1,96 (1,792–2,198) |
1,847 (1,632–2,107) |
0,50 |
Примітка. При порівнянні показників використано критерій Крускала – Уолліса. Вказано медіанне значення (Ме), у круглих дужках вказані значення QI і QIII, а в квадратних – мінімальне і максимальне значення показника вмісту фракталкіну в сироватці крові. Не було виявлено відмінностей за середнім рівнем між пацієнтами 4 груп (p = 0,50 за критерієм Крускала – Уолліса).
Для аналізу зв’язку рівня показників фракталкіну із погіршенням стану макули за даними товщини NFL, GCL, IPL, central sector, показників volume macula та volume fovea, minimum in fovea були використані методи побудови та аналізу однофакторних моделей регресії.
Аналіз зв’язку вмісту фракталкіну в крові із товщиною NFL + GCL + IPL
При проведенні аналізу негативним (вихідна змінна Y = 1) прийнято результат NFL + GCL + IPL ≥ 138 мкн (значення, більші за третій квартиль – QIII), в іншому разі Y = 0. Таким чином, проводили аналіз ризику високого (≥ 138 мкн) значення товщини NFL + GCL + IPL. У таблиці 2 представлені результати однофакторного аналізу.
Таблиця 2. Зв’язок показників умісту фракталкіну з ризиком високого значення товщини NFL + GCL + IPL
| Факторна ознака | Значення коефіцієнта моделі, b ± m | Рівень значущості відмінності коефіцієнта моделі від 0, p | Показник відношення шансів, ВШ (95 % ДІ) |
| Фракталкін | –0,24 ± 0,53 | 0,65 | – |
При проведенні аналізу не виявлено вірогідного зростання (p > 0,05) шансів наявності високого значення товщини NFL + GCL + IPL зі збільшенням рівня фракталкіну.
Аналіз зв’язку за NFL
При проведенні аналізу негативним (вихідна змінна Y = 1) прийнято результат NFL ≥ 42 мкн (значення, більші за QIII), в іншому разі Y = 0. Таким чином, проводили аналіз ризику високого (NFL > 31 мкн) значення NFL. У таблиці 3 представлені результати однофакторного аналізу.
Таблиця 3. Зв’язок показників умісту фракталкіну з ризиком високого значення товщини NFL
| Факторна ознака | Значення коефіцієнта моделі, b ± m | Рівень значущості відмінності коефіцієнта моделі від 0, p | Показник відношення шансів, ВШ (95 % ДІ) |
| Фракталкін | –0,59 ± 0,65 | 0,37 | – |
При проведенні аналізу не виявлено вірогідне зростання ризику високого значення товщини NFL зі збільшенням рівня фракталкіну (p > 0,05).
Аналіз зв’язку за GCL
При проведенні аналізу негативним (вихідна змінна Y = 1) прийнято результат GCL ≥ 97 мкн (значення, більші за QIII), в іншому разі Y = 0. Таким чином, проводили аналіз ризику високого (GCL ≥ 97 мкн) значення товщини GCL. У таблиці 4 представлені результати однофакторного аналізу.
Таблиця 4. Зв’язок показників умісту фракталкіну з ризиком високого значення товщини GCL
| Факторна ознака | Значення коефіцієнта моделі, b ± m | Рівень значущості відмінності коефіцієнта моделі від 0, p | Показник відношення шансів, ВШ (95 % ДІ) |
| Фракталкін | –0,66 ± 0,72 | 0,35 | – |
При проведенні аналізу не виявлено вірогідного зв’язку рівня фракталкіну із шансом наявності високого значення товщини GCL (p > 0,05).
Аналіз зв’язку за minimum in fovea
При проведенні аналізу негативним (вихідна змінна Y = 1) прийнято результат мінімального значення товщини fovea ≥ 333 мкн (значення, більші за QIII), в іншому разі Y = 0. Таким чином, проводили аналіз ризику наявності високого (≥ 333 мкн) значення товщини центральної ямки. У таблиці 5 представлені результати однофакторного аналізу.
Таблиця 5. Зв’язок показників умісту фракталкіну з ризиком високого значення мінімальної товщини центральної ямки
| Факторна ознака | Значення коефіцієнта моделі, b ± m | Рівень значущості відмінності коефіцієнта моделі від 0, p | Показник відношення шансів, ВШ (95 % ДІ) |
| Фракталкін | –0,31 ± 0,57 | 0,59 | – |
При проведенні аналізу не виявлено вірогідного зв’язку рівня фракталкіну із шансами наявності високого значення мінімальної товщини fovea (p > 0,05).
Аналіз зв’язку за central sector
При проведенні аналізу негативним (вихідна змінна Y = 1) прийнято результат central sector ≥ 407 мкн (значення, більші за QIII), в іншому разі Y = 0. Таким чином, проводили аналіз ризику високого (≥ 407 мкн) значення товщини central sector. У таблиці 6 представлені результати однофакторного аналізу.
Таблиця 6. Зв’язок показників умісту фракталкіну з ризиком високого значення товщини central sector
| Факторна ознака | Значення коефіцієнта моделі, b ± m | Рівень значущості відмінності коефіцієнта моделі від 0, p | Показник відношення шансів, ВШ (95 % ДІ) |
| Фракталкін | –0,67 ± 0,71 | 0,34 | – |
При проведенні аналізу не виявлено вірогідного зв’язку рівня фракталкіну з ризиком невисокого значення товщини central sector (p > 0,05).
Аналіз зв’язку за area thickness
При проведенні аналізу негативним (вихідна змінна Y = 1) прийнято результат area thickness ≥ 354 мкн (значення, більші за QIII), в іншому разі Y = 0. Таким чином, проводили аналіз ризику високого (≥ 354 мкн) значення товщини area thickness. У таблиці 7 представлені результати однофакторного аналізу.
Таблиця 7. Зв’язок показників умісту фракталкіну з ризиком високого значення товщини area thickness
| Факторна ознака | Значення коефіцієнта моделі, b ± m | Рівень значущості відмінності коефіцієнта моделі від 0, p | Показник відношення шансів, ВШ (95 % ДІ) |
| Фракталкін | –2,25 ± 1,02 | 0,03 | 0,11 (0,01 – 0,78) |
При проведенні аналізу виявлено вірогідне зниження (p = 0,03) ризику високого значення area thickness зі збільшенням рівня фракталкіну на кожен 1 нг/мл (ВШ = 0,11 (95 % ДІ 0,01–0,78)). Шанси високого значення area thickness зменшуються в 10 разів на кожну 1 нг/мл.
Для визначення порогового значення рівня фракталкіну використано ROCаналіз. На рисунку 1 представлено криву операційних характеристик цього тесту. Площа під ROC-кривою AUC = 0,67 (95 % ДІ 0,56–0,78), що свідчить про середній ступінь вираженості зв’язку рівня фракталкіну з ризиком високого значення area thickness.
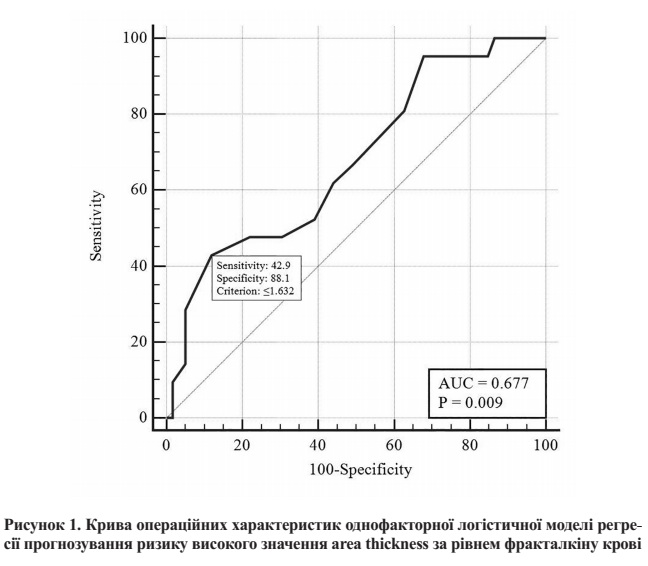
Встановлено, що при значенні рівня фракталкіну ≤ 1,632 нг/мл прогнозується ризик високого (≥ 354 мкн) значення area thickness, в іншому разі – прогноз сприятливий. При обраному оптимальному порозі чутливість тесту становить 42,9 % (95 % ДІ 21,8–70,2 %), специфічність – 88,4 % (95 % ДІ 77,1–95,1 %), ППЗ = 56,2 % (95 % ДІ 35,4–75,1 %), ПНЗ = 81,2 % (95 % ДІ 74,7–86,4 %).
Аналіз зв’язку за volume macula
При проведенні аналізу негативним (вихідна змінна Y = 1) прийнято результат volume macula ≥ 9,92 мм3 (значення, більші за QIII), в іншому разі Y = 0. Таким чином, проводили аналіз ризику високого (≥ 9,92 мм3) значення volume macula. У таблиці 8 представлені результати однофакторного аналізу.
Таблиця 8. Зв’язок показників умісту фракталкіну з ризиком високого значення volume macula
| Факторна ознака | Значення коефіцієнта моделі, b ± m | Рівень значущості відмінності коефіцієнта моделі від 0, p | Показник відношення шансів, ВШ (95 % ДІ) |
| Фракталкін | –1,38 ± 0,88 | 0,12 | – |
При проведенні аналізу не виявлено зв’язку рівня фракталкіну з ризиком високого значення volume macula (p > 0,05).
Аналіз зв’язку за volume fovea
При проведенні аналізу негативним (вихідна змінна Y = 1) прийнято результат volume fovea ≥ 0,36 мм3 (значення, більші за QIII), в іншому разі Y = 0. Таким чином, проводили аналіз ризику не низького (≥ 0,36 мм3) значення volume fovea. У таблиці 9 представлені результати однофакторного аналізу.
Таблиця 9. Зв’язок показників умісту фракталкіну з ризиком високого значення volume fovea
| Факторна ознака | Значення коефіцієнта моделі, b ± m | Рівень значущості відмінності коефіцієнта моделі від 0, p | Показник відношення шансів, ВШ (95 % ДІ) |
| Фракталкін | –1,18 ± 0,84 | 0,16 | – |
При проведенні аналізу не виявлено вірогідного зв’язку рівня фракталкіну з ризиком високого значення volume fovea (p > 0,05).
ОБГОВОРЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ
Дослідження вмісту фракталкіну в сироватці крові показало певне його підвищення при ДМН-2 за середніми значеннями (до 1,96 нг/мл) та при ДМН-3 за абсолютними (до 5,585 нг/мл). Нами визначено порогове значення рівня фракталкіну ≤ 1,632 нг/мл при чутливості тесту 42,9 % і специфічності 88,4 %. При цьому концентрація фракталкіну має вірогідний середній ступінь вираженості зв’язку із ризиком високого значення area thickness. При менших за поріг рівнях фракталкіну сироватки крові ймовірність шансів виникнення високого значення area thickness становить 56,2 %, при більших – 81,2 %.
Виявлений нами факт наявності вірогідного зменшення (у 10 разів) шансів високого значення area thickness із зростанням рівня фракталкіну на кожен 1 нг/мл лише на перший погляд вступає у протиріччя з тим, що при більших за поріг рівнях фракталкіну сироватки крові ймовірність шансів виникнення високого значення area thickness зростає (до 81,2 %). Це вказує на те, що підвищення концентрації фракталкіну в плазмі крові за визначений поріг певний час може бути індикатором активного неспецифічного запального процесу в нейроглії, набряку та передвісником загибелі гангліонарних клітин і втрати зору (зокрема для ризику високого значення area thickness). Результатом протективного впливу фракталкіну може бути або поліпшення морфо-функціонального стану та зменшення набряку макули, або за умов його зменшення в крові – ризик високого значення area thickness у половини пацієнтів з ДМН і подальша нейродегенерація сітківки та втрата зору, оскільки активована мікроглія, активація резидентних гліальних клітин з індукцією синтезу цілої низки прозапальних цитокінів та хемокінів (первинних індикаторів запального процесу і пошкодження) діють за типом двосічного меча [37], можуть бути як нейропротекторами (захисна реакція), так і спричинювати пошкодження нейронів сітківки [38, 39].
За даними літератури, за допомогою внутрішньовенної доставки фракталкіну та збільшення таким чином передачі сигналів через зв’язок CX3CL1/CX3CR1 зменшуються мікрогліальна активація і дегенерація фоторецепторів у моделі пігментного ретиніту [40]. При дослідженні вмісту 37 хемокінів у рідкій волозі ока, що відзначено в пацієнтів з ДМН і непроліферативною ДРП, концентрація фракталкіну достовірно збільшувалася там на 60-й день лікування афліберцептом (30,55 пг/мл: 18,90; 51,76) порівняно з базовим рівнем (16,3 пг/мл: 1,61; 44,88, р < 0,035), залишаючись високою на 120-й день лікування (27,77 пг/мл: 4,61; 41,22). При цьому морфологічні параметри, такі як товщина сітківки і щільність судин сітківки, значно покращилися протягом 5-місячного періоду спостереження [41], хоча цілісність еліпсоїдальної смуги і збереження зовнішньої граничної мембрани є предикторами функціонального поліпшення зору після лікування [42].
Таким чином, фракталкін має перспективний терапевтичний потенціал для використання його для зменшення патогенного впливу ЦД 2-го типу на нейросудинну одиницю сітківки ока.
ВИСНОВКИ
1. У хворих із ЦД 2-го типу вірогідно зменшуються шанси наявності високого значення товщини area thickness на кожну 1 нг/мл.
2. Зв’язок рівня фракталкіну з високим значенням area thickness має середній ступінь вираженості.
3. Пороговим значенням умісту фракталкіну сироватки крові для високого значення (≥ 354 мкн) area thickness визначено ≤ 1,632 нг/мл при чутливості тесту 42,9 % і специфічності 88,4 %.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Oliveira MIA, de Souza EM, de Oliveira Pedrosa F, et al. RAGE receptor and its soluble isoforms in diabetes mellitus complications. J Bras Patol Med Lab. 2013;49:97–108. http:// dx.doi.org/10.1590/S1676-24442013000200004
- Saf SZ, Qvist R, Kumar S, et al. Molecular mechanisms of diabetic retinopathy, general preventive strategies, and novel therapeutic targets. BioMed Research International. 2014; 2014:801269.
- Kronenberg HM, Williams RH. Williams Textbook of Endocrinology. 11th ed. Philadelphia, PA: Elsevier Saunders; 2008.
- Grigsby JG, Cardona SM, Pouw CE, et al. The role of microglia in diabetic retinopathy. J Ophthalmol. 2014;2014:705783. http://dx.doi.org/10.1155/2014/705783
- National Eye Institute [Internet]. Facts About Diabetic Eye Disease; [about 1 screen]. Available from: https://nei.nih.gov/health/diabetic/retinopathy
- Rangasamy S, McGuire PG, Das A. Diabetic retinopathy and inflammation: novel therapeutic targets. Middle East Afr J Ophthalmol. 2012;19(1):52–9. http://dx.doi.org/10.4103/ 0974-9233.92116
- Wisse BE. The inflammatory syndrome: the role of adipose tissue cytokines in metabolic disorders linked to obesity. J Am Soc Nephrol. 2004;15:2792–800.
- Malachkova NV, Kyryliuk ML, Komarovska IV. Serum adiponectin levels in obese type 2 diabetic patients with diabetic retinopathy. J ophthalmol (Ukraine). 2017;5:39–44. http://dx. doi.org/10.31288/oftalmolzh201753944
- Malachkova NV, Kyryliuk ML, Komarovska IV. Association between serum resistin level and diabetic retinopathy in obese patients with type 2 diabetes mellitus. J ophthalmol (Ukraine). 2017;4:9–13. http://dx.doi.org/10.31288/oftalmolzh20174913
- Serdiuk VN, Kyryliuk ML, Ishchenko VA. Mathematical substantiation of the method for assessing the risk of progression of diabetic retinopathy with serum leptin determination in patients with metabolic syndrome and diabetes mellitus. J ophthalmol (Ukraine). 2018;2: 17–22. http://dx.doi.org/10.31288/oftalmolzh/2018/2/1721
- Serdiuk VN, Kyryliuk ML, Pylypenko LYu. Activity of plasminogen activator inhibitor-1 in blood of patients with metabolic syndrome depending on a stage of diabetic retinopathy. J ophthalmol (Ukraine). 2018;3:52–6. http://dx.doi.org/10.31288/oftalmolzh201835256
- Bringmann A, Iandiev I, Pannicke T, et al. Cellular signaling and factors involved in Müller cell gliosis: neuroprotective and detrimental effects. Prog Retin Eye Res. 2009;28:423–51.
- Simó R, Hernández C. European Consortium for the Early Treatment of Diabetic Retinopathy (EUROCONDOR). Neurodegeneration in the diabetic eye: new insights and therapeutic perspectives. Trends Endocrinol Metab. 2014;25:23–33.
- Bringmann A, Pannicke T, Grosche J, et al. Müller cells in the healthy and diseased retina. Prog Retin Eye Res. 2006;25:397–424.
- Ascaso FJ, Huerva V, Grzybowski A. The role of inflammation in the pathogenesis of macular edema secondary to retinal vascular diseases. Mediators Inflamm. 2014;2014:432685.
- Zeng HY, Green WR, Tso MO. Microglial activation in human diabetic retinopathy. Arch Ophthalmol. 2008;126:227–32.
- Pelino CJ, Pizzimenti JJ. Contemporary care protocols for DR and DME. Rev Optom. 2012;149(8):90–9.
- Boyer DS. Insights into the pathophysiology of diabetic macular edema. A growing body of scientific evidence reveals multiple therapeutic targets. Supplement to retina today. 2015 November/December;12–15.
- Kuhtina NB, Aref’eva TI, Ruleva NYu, et al. Peptidnye fragmenty hemokinovogo domena fraktalkina: vliyanie na migraciyu monocitov cheloveka. Bioorg Himiya. 2012;38(6):660–6.
- Schall T. Fractalkine – a strange attractor in the chemokine landscape. Immunol Today. 1997;18(4):147.
- Bazan JF, Bacon KB, Hardiman G. A new class of membrane-bound chemokine with a CX3C motif. Nature. 1997;385(6617):640–4.
- Mesnyankina OA, Yanchevskaya EY, Ben M. [Fractalkine: pathogenic role and diagnostic capabilities]. Kuban Scientific Medical Bulletin. 2017;1(2):148–51. (in Russian). https://doi. org/10.25207/1608-6228-2017-2-148-151
- Imai T, Hieshima K, Haskell C, et al. Identification and molecular characterization of fractalkine receptor CX3CR1, which mediates both leukocyte migration and adhesion. Cell. November 1997;91(4):521–30. https://doi.org/10.1016/S0092-8674(00)80438-9. PMID 9390561
- Shah R, Hinkle CC, Ferguson JF, et al. Fractalkine is a novel human adipochemokine associated with type 2 diabetes. Diabetes. 2011;60:1512–8.
- Atlas of Genetics and Cytogenetics in Oncology and Haematology [internet]. ATLAS; c2019. CX3CR1 (C-X3-C motif chemokine receptor 1); [about 1 screen]. Available from: http://atlasgeneticsoncology.org/Genes/GC_CX3CR1.html
- Sawai H, Park YW, He X, et al. Fractalkine mediates T cell-dependent proliferation of synovial fibroblasts in rheumatoid arthritis. Arthritis Rheum. 2007;56(10):3215–25.
- Perros F, Dorfmuller P, Souza R, et al. Fractalkine-induced smooth muscle cell proliferation in pulmonary hypertension. Eur Respir J. 2007;29(5):937–43.
- Hatori K, Nagai A, Heisel R, et al. Fractalkine and fractalkine receptors in human neurons and glial cells. J. Neurosci Res. 2002;69(3):418–26.
- White GE, Tan TC, John AE, et al. Fractalkine has antiapoptotic and proliferative effects on human vascular smooth muscle cells via epidermal growth factor receptor signaling. Cardiovascular Research. 2010;85:825–35.
- Beli E, Dominguez JM 2nd, Hu P, et al. CX3CR1 deficiency accelerates the development of retinopathy in a rodent model of type 1 diabetes. J Mol Med (Berl). 2016;94:1255–65. https://doi.org/10.1007/s00109-016-1433-0
- Cardona AE, Pioro EP, Sasse ME, et al. Control of microglial neurotoxicity by the fractalkine receptor. Nat Neurosci. 2006;9:917–24.
- Cardona SM, Mendiola AS, Yang YCh, et al. Disruption of Fractalkine Signaling Leads to Microglial Activation and Neuronal Damage in the Diabetic Retina. ASN Neuro. 2015; 7(5):1759091415608204. https://doi.org/10.1177/1759091415608204
- American Academy of Ophthalmology [internet]. San Francisco: AAO; c2019 [Updated 2017 Dec]. Diabetic Retinopathy; [about 1 screen]. Available from: www.aao.org/ppp
- Altman DG, Machin D, Bryant TN, Gardner MJ, editors. Statistics with confidence: confidence intervals and statistical guidelines. London: BMJ Books; 2003.
- Jekel JF, Katz DL, Elmore JG, Dorothea MG. Epidemiology, biostatistics, and preventive medicine. 3d ed. Philadelphia: Saunders Elsevier; 2007.
- Kanda Y. Investigation of the freely available easy-to-use software ‘EZR’ for medical statistics. Bone Marrow Transplant. 2013;48:452–8.
- Ransohoff RM, Cardona AE. The myeloid cells of the central nervous system parenchyma. Nature. 2010;468:253–62.
- Aloisi F. Immune function of microglia. Glia. 2001;36:165–79.
- Benveniste EN. Role of macrophages/microglia in multiple sclerosis and experimental allergic encephalomyelitis. Journal of Molecular Medicine. 1997;75:165–73.
- Zabel MK, Zhao L, Zhang Y, et al. Microglial phagocytosis and activation underlying photoreceptor degeneration is regulated by CX3CL1-CX3CR1 signaling in a mouse model of retinitis pigmentosa. Glia. 2016;64:1479–91.
- Mastropasqua R, D’Aloisio R, Di Nicola M, et al. Relationship between aqueous humor cytokine level changes and retinal vascular changes after intravitreal aflibercept for diabetic macular edema. Scientific Reports. 2018;8:16548. https://doi.org/10.1038/s41598-018-35036-9
- Muftuoglu IK, Mendoza N, Gaber R, et al. Integrity of outer retinal layers after resolution of central involved diabetic macular edema. Retina. 2017;37:2015–24.
Стаття надійшла в редакцію 27.03.2019 р.
Рецензія на статтю надійшла в редакцію 09.04.2019 р.