- Автор: Super User
- Категорія: №2 (10) 2019
- Опубліковано: 26 грудня 2019
- Перегляди: 3939
УДК 617.7–089
https://doi.org/10.30702/Ophthalmology.2019/105564
Новицький І. Я.1, 2, д-р мед. наук, професор
Рудавська Л. М.3, лікар-офтальмолог, завідувач відділення мікрохірургії ока
1Львівський національний медичний університет імені Данила Галицького, Комунальна 8-а міська клінічна лікарня м. Львова, м. Львів, Україна
2Медичний центр «Окулюс», м. Львів, Україна
3Волинська обласна клінічна лікарня, м. Луцьк, Україна
Резюме
Мета дослідження. Вивчити вплив непроникної глибокої склеректомії (НГСЕ) з одномоментною діодною лазерною трабекулопластикою ab externo на перебіг глаукомної оптичної нейропатії.
Матеріали та методи. 94 пацієнтам (94 ока) із некомпенсованою первинною відкритокутовою глаукомою (ПВКГ) виконано операцію НГСЕ з одномоментною діодною лазерною трабекулопластикою ab externo. Проводили загальноофтальмологічні дослідження, статичну автоматичну периметрію (САП), оптичну когерентну томографію (ОКТ) диска зорового нерва (ДЗН) і шару нервових волокон сітківки.
Результати. До операції внутрішньоочний тиск (ВОТ) становив 27,1 ± 2,2 мм рт. ст. Через 1 рік після операції середній рівень ВОТ досягнув 19,1 ± 1,2 мм рт. ст., через 2 роки – 19,8 ± 2,6 мм рт. ст. За даними САП, показники головних дефектів становили до операції –8,1 ± 6,9 дБ, через 1 рік після операції –8,5 ± 6,9 дБ, через 2 роки –8,9 ± 7,0 дБ, стандартне відхилення стимулу – 6,5 ± 4,2, 6,7 ± 4,2 та 6,3 ± 4,1 дБ відповідно. Товщина шару нервових волокон сітківки протягом першого року зменшилась на 1,1 нм (від 65,3 ± 16,5 до 64,2 ± 16,3 нм) і протягом другого року – на 0,6 нм (від 64,2 ± 16,3 до 63,6 ± 15,9 нм).
Висновок. Непроникна глибока склеректомія із лазерною трабекулопластикою ab externo є ефективною операцією для зниження ВОТ при ПВКГ протягом 2 років. За даними САП та ОКТ ДЗН і шару нервових волокон сітківки, операція призводить до сповільнення прогресування глаукомної оптичної нейропатії.
Ключові слова: первинна відкритокутова глаукома, внутрішньоочний тиск, диск зорового нерва, непроникна глибока склеректомія, лазерна трабекулопластика, статична автоматична периметрія, оптична когерентна томографія.
Novytskyy I.1, 2, Rudavska L.3
1Danylo Halytsky Lviv National Medical University, Lviv City Clinical Hospital No 8, Lviv, Ukraine
2Oculus Medical Center, Lviv, Ukraine
3Volyn Regional Clinical Hospital, Lutsk, Ukraine
The Influence of Nonpenetrating Deep Sclerectomy with Ab Externo Diod Laser Trabeculoplasty on Glaucomatous Optical Neuropathy Progression
Abstract
Introduction. The main criteria of the glaucomatous optic neuropathy stabilization are the level of the intraocular pressure (IOP), progression of the visual fields (VF) loss, morphometric data of the optic nerve head (ONH) and thickness of retinal nerve fiber layer (RNFL).
Purpose. To study the influence of the nonpenetrating deep sclerectomy with diod laser trabeculoplasty ab externo for glaucomatous optical neuropathy progression.
Methods. 94 patients (94 eyes) with primary open angle glaucoma (POAG) underwent nonpenetrating deep sclerectomy with diod laser trabeculoplasty ab externo. Maclakov’s tonometry was performed before the procedure, 7 days and every 3 months afterwards. Visual field testing was conducted before and every 4 months after the surgery. Optic coherence tomography (OCT) of the ONH and the thickness of the RNFL were analyzed twice a year.
Results. The mean IOP before the surgery was 27.1 ± 2.2 mm Hg. 1 and 2 years after the surgery IOP was 19.1 ± 1.2 mm Hg, and 19.8 ± 2.6 mm Hg accordingly. Mean defect VF before the surgery was -8.1 ± 6.9 dB, one year after the surgery -8.5 ± 6.9 dB, and -8.9 ± 7.0 dB two years after the surgery. Standard deviation of the stimulus was 6.5 ± 4.2, 6.7 ± 4.2 and 6.3 ± 4.1 dB accordingly. RNFL thickness during the first year declined from 65.3 ± 16.5 µm to 64.2 ± 16.3 µm, and during the second year – to 63.6 ± 15.9µm.
Conclusion. Nonperforatin deep sclerectomy with diod laser trabeculoplasty ab externo is an effective surgical procedure for IOP reduction for patients with POAG. VF testing and OCT of ONH and RNFL thickness have shown the slowing down the progression of the disease.
Keywords: primary open angle glaucoma, intraocular pressure, optic nerve head, nonperforating deep sclerectomy, laser trabeculoplasty, standard automated perimetry, optic coherence tomography.
Вступ
Первинна відкритокутова глаукома (ПВКГ) – це хронічна прогресуюча нейропатія із типовими змінами диска зорового нерва (ДЗН), ретинальних гангліонарних клітин та їх аксонів і відповідними патологічними змінами в полях зору. Загальновизнано, що єдиним достовірним методом лікування глаукоми є зниження внутрішньоочного тиску (ВОТ) [2, 9, 10, 12, 17, 25].
Основними критеріями стабілізації ПВКГ є показники полів зору, морфометричні дані ДЗН і рівень ВОТ. Дослідження показали ефективність зниження втрати полів зору в пацієнтів після стандартної синустрабекулектомії на 18–85 % [3, 5, 7, 8, 16, 20, 24].
При неперфоруючих глибоких склеректоміях досягнення ВОТ нижче 21 мм рт. ст. за Гольдманом упродовж 3 років, за даними авторів, спостерігається лише у 44,5 % пацієнтів. Близько 40 % із них потребують додаткових хірургічних маніпуляцій для зниження ВОТ [15, 18, 22, 23].
Нами було розроблено операцію непроникаючої глибокої склеректомії в комбінації з одномоментною діодною лазерною требекулопластикою ab externo, при застосуванні якої досягнуто рівня ВОТ менше 22 мм рт. ст. за Маклаковим у 78,2 % пацієнтів [1].
Мета дослідження
Вивчити вплив непроникної глибокої склеректомії з одномоментною діодною лазерною трабекулопластикою ab externo на перебіг глаукомної оптичної нейропатії.
Матеріали та методи
Під нашим спостереженням перебувало 94 пацієнти (94 ока) з некомпенсованою ПВКГ, із них 45 чоловіків та 49 жінок. Середній вік становив 65,2 ± 5,2 року. Усім пацієнтам було виконано операцію непроникної глибокої склеректомії з одномоментною діодною лазерною трабекулопластикою ab externo [1].
У 41 пацієнта (44,5 %) відзначали ранні зміни полів зору, у 38 (40,4 %) – помірні втрати в полях зору та у 15 пацієнтів (15,9 %) – виражені зміни. Глаукомні втрати поля зору визначалися за класифікацією Hodapp [13], рекомендованих наказом МОЗ України № 816 від 23 листопада 2011 р.:
1) ранні:
– головні дефекти > –6 дБ;
– 5 % можливий рівень дефекту для < 18 тестових точок (розміщень тестового поля);
– 1 % можливий рівень дефекту < 10 тестових точок;
2) помірні:
– головні дефекти –6…–12 дБ;
– 5 % можливий рівень дефекту для < 37 тестових точок;
– 1 % можливий рівень дефекту < 20 тестових точок;
– чутливість < 15 дБ в центральних 5º тільки з одного боку;
3) виражені:
– головні дефекти –12…–20 дБ;
– 5 % можливий рівень дефекту для > 37 тестових точок;
– 1 % можливий рівень дефекту > 20 тестових точок;
– чутливість < 15 дБ у центральних градусах в обох полях зору.
Кожному пацієнту проводили статичну автоматичну периметрію (САП) та оптичну когерентну томографію (ОКТ) диска зорового нерва та шару нервових волокон сітківки. Статичну периметрію виконували через кожних 4 місяці, ОКТ – 2 рази на рік. Тонометрію за Маклаковим проводили до операції, через 7 днів, 1 місяць і в подальшому – через кожні 3 місяці після операції.
Статичну автоматичну периметрію проводили на периметрі Twinfeld (Oculus) з використанням програми 24-2 SITA standart. Результати брали до уваги за умови критеріїв достовірності < 20 % втрати фіксації, < 25 % несправжньо-позитивних відповідей і < 25 % несправжньо-негативних відповідей. Критерії включення: пацієнти з «досвідом» периметрії, гострота зору з корекцією вища 0,5. Критерії виключення: аметропія зі сферою більше 5,0 діоптрій, циліндр більше 2 діоптрій, супутні захворювання сітківки, супутні патології зорового нерва.
Оцінювання прогресування глаукомної оптичної нейропатії, за даними статичної периметрії, здійснювали за такими критеріями:
– загальне зниження світлочутливості (MD), яке не можна пояснити зниженням прозорості оптичних середовищ ока з вірогідністю меншою, ніж 0,05 у дБ;
– стандартне відхилення стимулу – вираженість вогнищевих змін або варіабельність дефектів (PSD – pattern standart deviation) у дБ.
Анатомічними критеріями прогресування глаукоми були товщина шару нервових волокон сітківки і морфометричні дані ДЗН. Для цього проводили ОКТ ДЗН і шару нервових волокон сітківки циркулярно до ДЗН в радіусі 3,2 мм. Дослідження здійснювали на апараті Topcon (Японія) з використанням Fast RNFL Thickness acquisition protocol і програми version 4.0 software. При діаметрі зіниці меншим за 3 мм для її розширення застосовували 0,5 % тропікамід.
Товщину шару нервових волокон сітківки визначали у 256 точках навколо ДЗН в радіусі 3,2 мм як середнє значення усіх точок. Окремо визначали товщину шару нервових волокон сітківки у верхньому і нижньому квадрантах.
Зміни ДЗН аналізували за такими даними: співвідношення глаукомної екскавації до діаметра диска у вертикальному меридіані, за площею і об’ємом нейроретинального пояска.
Результати та обговорення
До операції ВОТ становив 27,1 ± 2,2 мм рт. ст. Через 1 місяць після операції ВОТ – 17,9 ± 1,1 мм рт. ст. (р < 0,001), гіпотензивні краплі додатково не застосовували. Через 6 місяців після операції ВОТ у середньому досягав 18,9 ± 1,1 мм рт. ст. У 76 пацієнтів (80,9 %) було досягнуто цільових значень ВОТ. Десять пацієнтів (10,6 %) додатково застосовували аналоги простагландинів. У 8 (8,5 %) значення ВОТ були вище ніж 22 мм рт. ст. із максимальною гіпотензивною терапією. У цих пацієнтів було проведено лазерну десцеметогоніопунктуру. Подальші дані цих пацієнтів не враховували у цьому дослідженні.
Через 1 рік після операції під спостереженням перебувало 79 пацієнтів (79 очей). Середнє значення ВОТ становило 19,1 ± 1,2 мм рт. ст. У 57 пацієнтів (72,2 %) ВОТ утримувався менше 22 мм рт. ст. без додаткової гіпотензивної терапії, 14 пацієнтів (17,7 %) застосовували місцево гіпотензивні краплі. У 8 пацієнтів (10,1 %) ВОТ утримувався вище ніж 22 мм рт. ст. на краплях. Кількість медикаментів для досягнення цільового тиску становила 0,6 ± 0,1. Двом пацієнтам із 8 (2,5 %) проведено лазерну десцеметогоніопунктуру, ще чотирьом (5,1 %) – повторну антиглаукомну операцію: синустрабекулектомію з базальною іридектомією. Пацієнти після додаткових операцій виключались із подальшого дослідження.
Через 2 роки під спостереженням перебувало 64 пацієнти (64 ока). Середнє значення ВОТ становило 19,8 ± 2,6 мм рт. ст. При цьому в 36 пацієнтів (36 очей, 56,2 %) ВОТ відповідав цільовому тиску, 20 пацієнтів (31,3 %) додатково застосовували гіпотензивну терапію. У 8 пацієнтів (12,5 %) ВОТ утримувався вище 22 мм рт. ст., незважаючи на максимально переносиму медикаментозну терапію. Кількість гіпотензивних препаратів становила 1,1 ± 0,3. П’ятьом пацієнтам (5 очей, 7,8 %), у яких не досягнуто цільового тиску, проведено синустрабекулектомію з іридектомією.
До операції у хворих з ранніми змінами поля зору MD становило –3,2 ± 2,1 дБ, з помірними змінами –8,5 ± 6,7 дБ і у хворих з вираженими змінами поля зору –16,2 ± 10,3 дБ. Середнє значення MD становило –8,1 ± 6,9 дБ.
PSD до операції у хворих з ранніми змінами поля становило 2,6 ± 1,8 дБ, з помірними змінами – 6,3 ± 4,1 дБ і у хворих з вираженими змінами поля зору – 8,3 ± 6,9 дБ. Середнє значення PSD – 5,9 ± 4,2 дБ.
Прогресування MD за рік становило в середньому 0,4 ± 0,3 дБ. При цьому у 8 хворих з 43 (23,3 %) загальна світлочутливість підвищилася на 0,3 ± 0,2 дБ. Прогресування PSD за рік сягало в середньому 0,2 ± 0,2 дБ. При цьому у 8 хворих із 43 (23,3 %) варіабельність дефектів знизилася на 0,2 ± 0,1 дБ.
Динаміка зниження світлочутливості і варіабельності дефектів за стадіями наведена в таблиці 1.
Таблиця 1. Прогресування глаукомної оптичної нейропатії за даними статичної периметрії
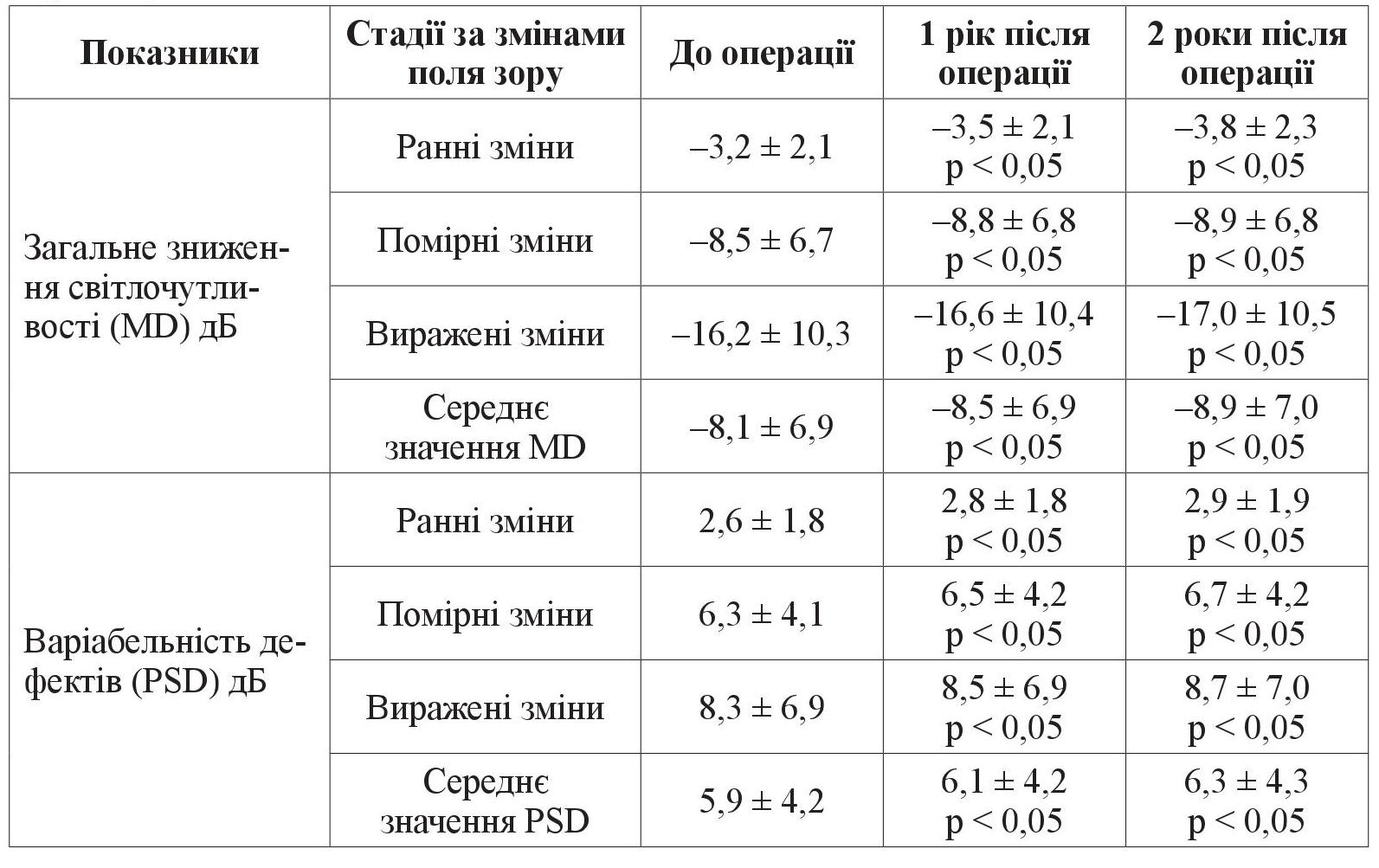
Аналіз прогресування глаукомної оптичної нейропатії залежно від компенсації ВОТ показав, що у хворих з абсолютним і відносним ефектом операції (ВОТ 22 мм рт. ст. і нижче без або із застосуваням медикаментів), за даними статичної периметрії, прогресування глаукомної оптичної нейропатії відбувалося значно повільніше. Так, у хворих з ВОТ 22 мм рт. ст. або нижче через 12 місяців загальна світлочутливість знизилася на 0,3 ± 0,2, у той час як у хворих з ВОТ вищим, ніж 22 мм рт. ст. – на 0,5 ± 0,3 (р < 0,05). Варіабельність дефектів при ВОТ ≤ 22 мм рт. ст. підвищилася на 0,1 ± 0,1, у той час як у хворих з ВОТ вищим, ніж 22 мм рт. ст. – на 0,3 ± 0,2 (р < 0,05).
Товщина шару нервових волокон сітківки до операції становила 65,3 ± 16,5 нм, у верхньому квадранті – 73,4 ± 21,9 нм, у нижньому – 75,3 ± 27,3 нм. Через 1 і 2 роки після операції спостерігалося незначне стоншення шару нервових волокон сітківки (таблиця 2).
Таблиця 2. Динаміка морфометричних даних ДЗН
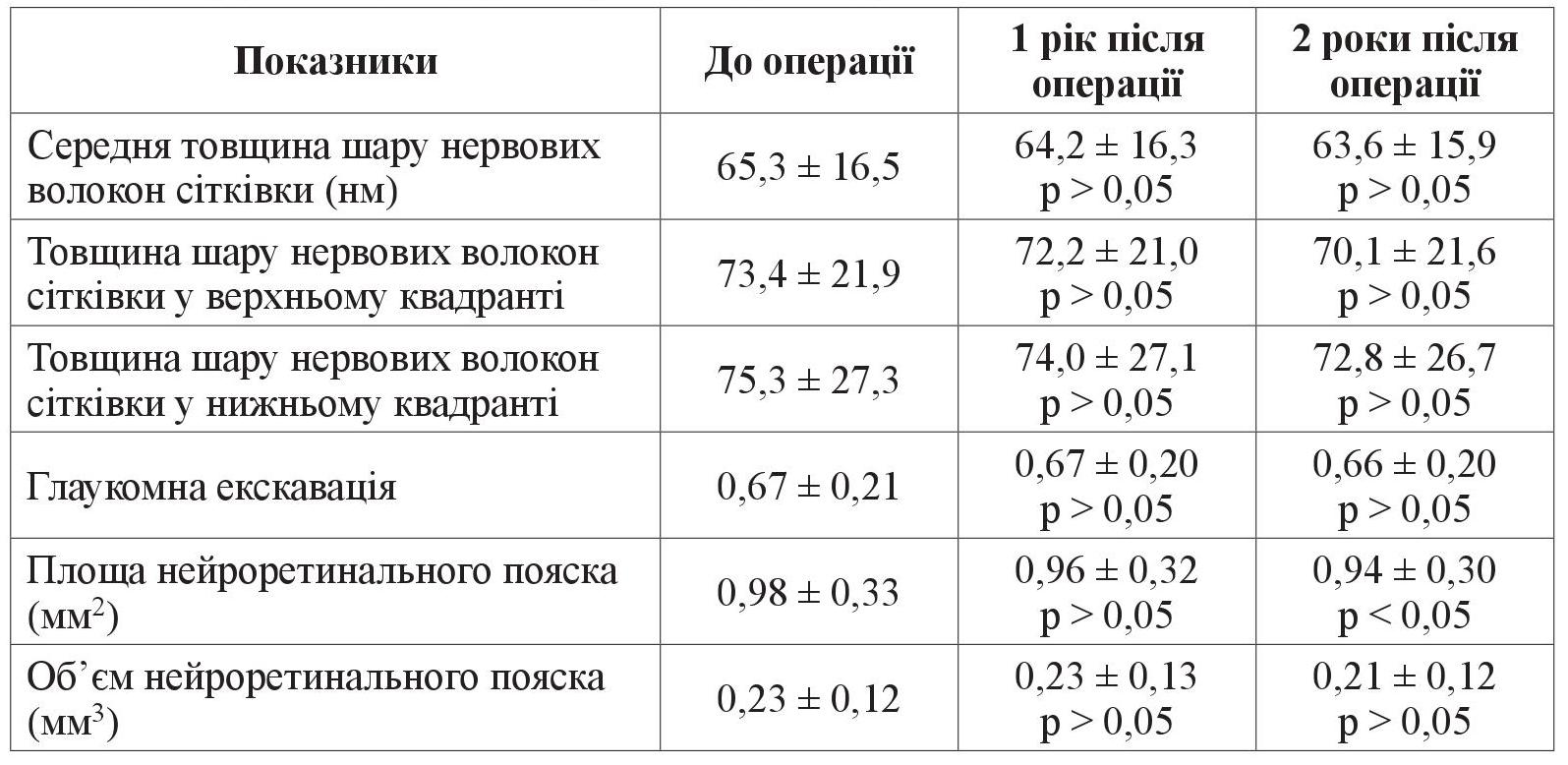
Примітка. р – коефіцієнт достовірності між показниками до і після операції.
Співвідношення діаметра екскавації до діаметра ДЗН у вертикальному меридіані до операції становило 0,67 ± 0,21, площа нейроретинального пояска – 0,98 ± 0,33 мм2, об’єм нейроретинального пояска – 0,23 ± 0,12 мм3. Через 1 і 2 роки після операції морфометричні показники ДЗН практично не змінилися.
Обговорення
Досліджень впливу хірургічних втручань на стабілізацію глаукомної нейропатії є порівняно небагато. Для оцінювання перебігу глаукомної нейропатії використовують як функціональні, так і морфометричні методи дослідження.
«Золотим стандартом» моніторингу глаукоми є статична автоматична периметрія (САП). Однак дані літератури щодо впливу хірургічного зниження ВОТ на поля зору пацієнтів залишаються контроверсійними. Частково це пов’язано з різними методами порівняння прогресії зорових функцій, а також коливанням даних САП в окремого пацієнта від обстеження до обстеження. Bhardwaj N, Niles P. I., Greenfeld D. S. et al. [4, 6] вказують, що для оцінювання прогресування глаукомних змін поля зору використовують різні показники. Автори дійшли висновку, що немає одного ідеального показника для виявлення прогресування змін поля зору глаукомного характеру. Серед інших достовірним є визначення загальної світлочутливості (MD). Pandey P. N. та Sujata S. [22] для виявлення змін поля зору використовували зміни середньої світлочутливості (MD), а також PSD.
Отримані нами результати змін поля зору, що свідчать про пряму залежність ступеня стабілізації прогресування глаукомного процесу від рівня зниження ВОТ. Ці результати корелюють з результатами досліджень [6], які виявили, що при зниженні ВОТ у середньому від 19 мм рт. ст. до 13 мм рт. ст. за Гольдманом втрата світлочутливості протягом року зменшилася від −1,0 ± 0,9 до −0,2 ± 0,38, а варіабельність дефектів підвищилась від 0,36 ± 1,01 до 0,32 ± 0,34.
Позитивний вплив зниження ВОТ після глибокої непроникної склеректомії в комбінації із діодною лазерною требекулопластикою на прогресування глаукомних змін поля зору, який ми виявили, збігається також з результатами дослідження Koseki та співавторів [16], які показали достовірне зниження прогресування змін поля зору після хірургічного лікування глаукоми, а також з дослідженнями Collaborative Initial Glaucoma Treatment Study (CIGTS), яке при спостереженні пацієнтів протягом 9 років засвідчило, що хірургічне лікування є більш ефективним у збереженні полів зору в пацієнтів зі значними втратами зорових функцій [19].
Відомо також, що зміни ДЗН передують змінам поля зору і не завжди корелюють між собою, вказують на необхідність комбінації функціональних і морфометричних методів дослідження для контролю прогресування глаукоми [26]. Тому в нашій роботі ми, як і багато інших авторів, використовували для моніторингу глаукомної нейропатії обидва методи оцінювання прогресування захворювання. Найбільш достовірним, повторюваним та об’єктивним методом при ПВКГ є ОКТ ДЗН та перипапілярної ділянки сітківки. Перевагою ОКТ є неінвазивність, комфортність для хворого та об’єктивність. Накопичена база даних, які є в програмах апаратів, показує високу достовірність, повторюваність і відтворюваність цього методу дослідження [14].
Результати морфометричних методів дослідження ДЗН, отримані нами, були менш показовими. Більш достовірними були результати вимірювання товщини шару нервових волокон сітківки. Також і Pandey A. N., Sujata S. [22] для оцінювання прогресування глаукомного процесу приймали зміну середньої товщини шару нервових волокон сітківки, а також товщину шару нервових волокон сітківки окремо у верхньому, нижньому, назальному і темпоральному меридіанах.
За результатами наших досліджень, середній рівень ВОТ через 1 рік після операції становив 19,1 мм рт. ст. і через 2 роки – 19,8 мм рт. ст. Товщина шару нервових волокон сітківки протягом першого року зменшилась на 1,1 нм (від 65,3 ± 16,5 нм до 64,2 ± 16,3 нм) і протягом другого року – на 0,6 нм (до 63,6 ± 15,9 нм). Подібні результати отримали і Alberto Diniz-Filho, Ricardo Y. Abe, Linda M. Zangwill та інші [11]: у разі зниження ВОТ до 15 мм рт. ст. за Гольдманом (орієнтовно 20 мм рт. ст. за Маклаковим) стоншення шару нервових волокон сітківки становило 0,82 нм за рік, у той час як у разі ВОТ 25 мм рт. ст. за Гольдманом (приблизно 30 мм рт. ст. за Маклаковим) – 2,82 нм за рік.
Конфлікт інтересів – відсутній.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
REFERENCES
- Рудавская ЛМ. Клиническая эффективность глубокой склерэктомии с одномоментной лазерной трабекулопластикой ab externo при открытоугольной глаукоме. Отдаленные результаты. Офтальмохирургия. 2016;2:35–40. Rudavska L. [Clinical effectiveness of deep nonperforating sclerectomy with simultaneous laser trabeculoplasty ab externo in patients with primary open angle glaucoma. Long term results]. Ophthlmosurgery. 2016;2:35–40. Russian.
- Пасечникова НВ, Рыков СА, Науменко ЛЮ и др. Профилактика слепоты и слабовидения в Украине (реализация программы ВОЗ «Vision-2020»). Актуальні питання офтальмології: наук.-практ. конф.: тези доп. Дніпрoпетровськ. 2009. С. 8–11. Pasechnikova NB, Rykov SA, Naumenko LU, et al. [Prophylactic of the blindness and low vision in Ukraine (realization of VOZ’s program “Vision-2020”)]. Current questions in ophthalmology: Proceedings of the scientific-practice conference. Dnipropetrovsk; 2009. p. 8–11. Russian.
- Иванов ДИ, Никулин МЕ. Трабекулотомия ab interno как гипотензивный компонент в комбинированной хирургии катаракты и глаукомы. Национальный журнал глаукома. 2011; 3:34–8. Ivanov DI, Nikulin ME. [Trabeculotomy ab interno as hypotensive component in combined cataract and glaucoma surgery]. National Journal of glaucoma. 2011;3:34–8. Russian.
- Barnett AG, van der Pols JC, Dobson AJ. Regression to the mean: what it is and how to deal with it. Int J. Epidemiol. 2005;34:215–20.
- Bertrand V, Fieuws S, Stalmans I, Zeyen T. Rates of visual field loss before and after trabeculectomy. Acta Ophthalmol. 2013;92:116–20.
- Bhardwaj N, Niles PI, Greenfeld DS, et al. The Impact of Surgical Intraocular Pressure Reduction on Visual Function Using Various Criteria to Defne Visual Field Progression. J Glaucoma. 2013;22 (8):632–7.
- Blackwell B, Gaasterland D, Ederer F.The Advanced Glaucoma Intervention Study (AGIS): 12. Baseline risk factors for sustained loss of visual field and visual acuity in patients with advanced glaucoma. Am J Ophthalmol. 2002;134:499–512.
- Caprioli J, De Leon JM, Azarbod P. Trabeculectomy can improve long-term visual function in glaucoma. Ophthalmology. 2016;123:117–28.
- Chauhan BC, Mikelberg FS, Balaszi AG, et al. Canadian Glaucoma Study: 2. risk factors for the progression of open-angle glaucoma. Arch Ophthalmol. 2008;126:1030–6.
- Cioffi GA, Liebmann JM. Translating the OHTS results into clinical practice. J. Glaucoma. 2002;11:375–7.
- Diniz-Filho A, Abe RY, Zangwill LM, et al. Association between Intraocular Pressure and Rates of Retinal Nerve Fiber Layer Loss Measured by Optical Coherence Tomography. Ophthalmology. 2016;123:2058–65.
- American Academy of Ophthalmology. Glaucoma. Basic and Clinical Science Course, Section 10, 2011–2012. San Francisco; 2011. p. 139–58.
- Hodapp E, Parrish RK, Anderson DR. Clinical decisions in glaucoma. St Louis: Mosby; 1993. p. 52–61.
- Kotowski J, Wollstein G, Folio LS, et al. Clinical Use of OCT in Assessing Glaucoma Progression. Ophthalmic Surg Lasers Imaging. 2011;42:S6–S14.
- Karlen ME, Sanchez E, Schnyder CC, et al. Deep sclerectomy with collagen implant: medium term results. Br J Ophthalmol. 1999;83:6–11.
- Koseki N, Araie M, Shirato S, Yamamoto S. Effect of trabeculectomy on visual field performance in central 30 degrees field in progressive normal-tension glaucoma. Ophthalmology. 1997;104:197–201.
- Kotecha A, Spratt A, Bunce C, et al. Optic disc and visual field changes after trabeculectomy. Invest Ophthalmol Vis Sci. 2009;50: 4693–9.
- Leske MC, Heijl A, Hussein M, et al. Factors for glaucoma progression and the effect of treatment: the early manifest glaucoma trial. Arch Ophthalmol. 2003;121:48–56.
- Migdal C, Gregory W, Hitchings R. Long-term functional outcome after early surgery compared with laser and medicine in open-angle glaucoma. Ophthalmology. 1994;101:1651–7.
- Musch DC, Gillespie BW, Lichter PR, et al. Visual field progression in the collaborative initial glaucoma treatment study the impact of treatment and other baseline factors. Ophthalmology. 2009;116 (2):200–7.
- Nouri-Mahdavi K, Brigatti L, Weitzman M, Caprioli J. Outcomes of trabeculectomy for primary open-angle glaucoma. Ophthalmology. 1995:102:1760–9.
- Pandey AN, Sujata S. Study of long term structural and functional changes in medically controlled glaucoma. Int J Ophthalmol. 2014;7:128–32.
- Sanchez E, Schnyder CC, Sickenberg M, et al. Deep sclerectomy: results with and without collagen implant. Int Ophthalmol. 1996–1997;20:157–62.
- Shigeeda T, Tomidokoro A, Araie M, et al. Long-term follow-up of visual field progression after trabeculectomy in progressive normal-tension glaucoma. Ophthalmology. 2002;109: 766–70.
- Wilson MR, Martone JF. Epidemiology of chronic open-angle glaucoma. In: Ritch R, Shield MB, Krupin T, editors. The Glaucomas. 2nd ed. St. Louis: Mosby Yearbook Inc; 1996. p. 753–68.
- Xin D, Greenstein VC, Ritch R, et al. A Comparison of Functional and Structural Measures for Identifying Progression of Glaucoma. Invest Ophthalmol Vis Sci. 2011;52 (1):519–26.
Стаття надійшла в редакцію 29.05.2019 р.
Рецензія на статтю надійшла в редакцію 25.06.2019 р.