- Автор: Super User
- Категорія: №2 (10) 2019
- Опубліковано: 26 грудня 2019
- Перегляди: 3971
УДК 617.735–002–02:616.633.66+616.155.2]–076.5
https://doi.org/10.30702/Ophthalmology.2019/10.126575
Панченко Ю. О., канд. мед. наук, лікар-офтальмолог
Київська міська клінічна офтальмологічна лікарня «Центр мікрохірургії ока», м. Київ, Україна
Медичний центр «ЛАЗЕР Плюс» м. Львів, Україна
Резюме. Пошук факторів ризику та прогнозування рецидиву після хірургічного лікування діабетичної макулопатії (ДМП) у хворих із цукровим діабетом 2-го типу (ЦД2) є актуальною проблемою. Інтерес викликає вивчення фактора некрозу пухлин-альфа (TNFα) у крові хворих із ЦД2 як можливого фактора ризику рецидиву ДМП. Метою нашого дослідження було вивчити зв’язок TNFα з рецидивом ДМП після хірургічного лікування у хворих із ЦД2.
Під спостереженням перебували 313 хворих із ЦД2 (313 очей) з ДМП та початковою (1-а група; n = 40), помірною або тяжкою непроліферативною діабетичною ретинопатією (НПДР; 2-а група; n = 92) та проліферативною діабетичною ретинопатією (ПДР; 3-я група; n = 181). Пацієнти отримували різні види вітреоретинального втручання. У пацієнтів до хірургічного втручання було визначено рівень TNFα у крові методом імуноферментного аналізу. Дослідження виявило зв’язок підвищеного вихідного рівня у крові TNFα з рецидивом ДМП після різних видів вітреоретинальних втручань.
Ключові слова: діабетична макулопатія, цукровий діабет 2-го типу, хірургічне лікування, TNFα.
Panchenko Iu. O.
Kyiv City Clinical Ophthalmological Hospital “Eye Microsurgery Center”, Kyiv, Ukraine Medical Center “LASER Plus”, Lviv, Ukraine
Tumor Necrosis Factor-Alpha (TNFα) with Relapses Development in Surgical Treatment of Diabetic Maculopathy in Type 2 Diabetes Mellitus
Abstract
Background. The search for relapses risk and prognosis factors in the surgical treatment of diabetic maculopathy (DMP) in patients with type 2 diabetes mellitus (T2DM) is very important. In this regard, our attention was drawn to an important pathogenetic factor of DMP – tumor necrosis factor-alpha (TNFα).
Aim. To study the relationship of TNFα with DMP relapse after its surgical treatment using various options for vitreoretinal interventions in patients with T2DM.
Materials and methods. We observed 313 patients with T2DM (313 eyes) with DMP and initial (group 1; n = 40), moderate or severe non-proliferative diabetic retinopathy (NPDR; group 2; n = 92) and proliferative diabetic retinopathy (PDR; group 3; n = 181). Four types of surgical interventions were used in patients: 78 patients underwent three-port closed subtotal vitrectomy; 85 patients underwent peeling of the inner limiting membrane in addition to these methods; 81 patients additionally received panretinal laser coagulation; cataract phacoemulsification was additionally performed in 69 patients. Prior to surgery, TNFα blood levels were determined by enzyme-linked immunosorbent assay. The control group consisted of 95 people. For statistical data processing, the program Statistica 10 (StatSoft, Inc., USA) was used.
Results. Before surgery the blood TNFα level was increased according to the severity of retinopathy: in group 1, the TNFα level exceeded the control group level by 1.2 (p = 0.005), in groups 2 and 3 – by 2.0 and 3.4 respectively (p < 0.001). In groups 1 and 2, in cases of DMP relapse, the level of TNFα was significantly higher than in case of no relapse, which was especially characteristic of patients with initial NPDR and related to early relapses. There was no association of TNFα level with DMP relapses in patients with PDR (group 3) – cytokine level was significantly increased, although this was more true for patients with PDR (the median was 49.2 pg/ml in case of relapse and 57.4 pg/ml in case of its absence; p = 0.062). Also, there was a higher level of TNFα in patients with early and persistent relapses (p < 0.05).
Conclusion. The study revealed a relationship between the elevation of TNFα baseline blood level and the formation of early and persistent relapses after surgical treatment of DMP.
Keywords: diabetic maculopathy, type 2 diabetes mellitus, surgical treatment, TNFα.
Вступ
Пошук факторів ризику та прогнозу діабетичної макулопатії (ДМП) у хворих із цукровим діабетом 2-го типу (ЦД2) є актуальною й досі остаточно не вирішеною проблемою [1, 2]. Крім низки клінічних чинників (тривалість та тяжкість захворювання, ступінь компенсації вуглеводного обміну, перехід на інсулінотерапію, куріння, ожиріння, артеріальна гіпертензія), найважливіше значення мають молекулярні регуляторні фактори [2–5]. Показано, що TNFα модулює дію інсуліну на рецептори шляхом індукції фосфорилювання субстрату інсулінового рецептора (IRS-1) за сериновими залишками 636/639 і, таким чином, гальмує фосфорилювання тирозину [6, 7]. Це запобігає подальшій активації кіназних шляхів (PI3K/Akt- і Erk/MAP-кіназ) та поглинанню глюкози [8]. Альтернативне фосфорилювання серину/тирозину IRS-1 в нормі регулює ефективність передачі сигналів інсуліну, тоді як при дії TNFα мультисайтове серин/тирозинове фосфорилювання призводить до блокування взаємодії IRS-1 і пептиду юкстамембранного домену, що переводить IRS-1 в неактивний стан і зумовлює резистентність до інсуліну [9].
Для лікування ДМП застосовують хірургічне лікування – вітректомію, яку за показаннями комбінують з панретинальною лазерною коагуляцією сітківки (ПРЛК) і пілінгом внутрішньої пограничної мембрани (ВПМ) сітківки [1, 12]. Закрита субтотальна вітректомія в поєднанні з операцією з видалення катаракти у хворих із ЦД2 має хороші результати без істотного підвищеного ризику зниження гостроти зору або інших ускладнень, що вказує на високу ефективність комбінованого хірургічного втручання [11].
Ми раніше повідомляли про ефективність різних технологій вітреоретинальних втручань у лікуванні ДМП у хворих із ЦД2, а також про частоту й особливість її рецидиву після хірургічного лікування [12, 13].
На нашу думку, патогенетичні фактори, що мають значення для формування ДМП, і в післяопераційному періоді будуть мати визначальну роль у формуванні ускладнень та рецидивів захворювання [14]. До таких факторів можуть бути віднесені прозапальні цитокіни [15].
Мета
Вивчити зв’язок TNFα з рецидивом діабетичної макулопатії після хірургічного лікування у хворих із ЦД2.
Матеріали та методи
Під нашим спостереженням перебувало 313 хворих із ЦД2 (313 очей) з ДМП та початковою (1-а група; n = 40), помірною або тяжкою непроліферативною діабетичною ретинопатією (НПДР; 2-а група; n = 92) та проліферативною діабетичною ретинопатією (ПДР; 3-я група; n = 181).
Усім хворим було проведено загальноприйняті офтальмологічні дослідження, що включали візометрію, статичну периметрію Humphrey, рефрактометрію, тонометрію, біомікроскопію, гоніоскопію, офтальмоскопію за допомогою асферичної лінзи Volk Super / Field (NC USA) і контактної тридзеркальної лінзи Гольдмана. Усім хворим виконували спектральнодоменну оптичну когерентну томографію (ОКТ) на приладі Optopoltechnology, SOCT, Copernicus REVO (протокол Retina3D, RetinaRaster) і ОКТ в режимі «Ангіо» (протокол RetinaAngio, wide 6 × 6 mm). Під час дослідження застосовували вдосконалений алгоритм аналізу знімків ОКТ макулярної ділянки сітківки [16]. Також проводили дослідження очного дна на фундус-камері з його фотографуванням в 7 стандартних полях відповідно до модифікованої ETDRS системи клінічних ознак AirlieHouse. Флуоресцентну ангіографію (ФАГ) виконували на апараті TOPCON TRS-NW7SF за показаннями (у разі підозри на початкову ретиновітреальну проліферацію чи неоваскуляризацію, яку не було ідентифіковано офтальмоскопічно і на фотографіях очного дна, а також у разі невідповідності зорових функцій офтальмоскопічним змінам у макулярній ділянці або даним ОКТ).
Ступінь тяжкості діабетичної ретинопатії та ДМП встановлювали відповідно до Міжнародної клінічної шкали діабетичної ретинопатії і діабетичної макулопатії Американської академії офтальмології (2002).
Показаннями для проведення закритої субтотальної вітректомії (ЗСВ) були прогресуюче зниження гостроти зору, зміни поля зору в центральних і парацентральних відділах, зміни якості зору на фоні непроліферативної діабетичної ретинопатії (НПДР) з рефрактерним макулярним набряком або макулярним набряком з наявністю тангенціальних тракцій, які з’явилися внаслідок неповного відшарування задньої гіалоїдної мембрани склистого тіла, а також проліферативної діабетичної ретинопатії (ПДР) з рефрактерним макулярним набряком, наявністю епіретинальних мембран, тангенціальних й осьових тракцій сітківки та загрозою тракційного відшарування сітківки, а також наявністю гемофтальму, преретинальних та субгілоїдальних крововиливів.
78 хворим (78 очей) провели трипортову ЗСВ 25+ на апараті Constellation Vision System («Alcon», США). Ендолазерним зондом 25 Ga виконували ПРЛК винятково у місцях, де були видалені вітреоретинальні тракції, з подальшою заміною рідини на стерильне повітря. У вітреальну порожнину вводили газо-повітряну суміш 18 % С3F8. Видаляли троакари та герметизували порти.
85 хворим (85 очей) під час виконання трипортової ЗСВ 25+ було додатково проведено пілінг ВПМ у макулярній ділянці діаметром 2,5–3,5 мм з попереднім уведенням у вітреальну порожнину барвника MembranBlue для чіткої візуалізації мембрани.
81 хворому (81 око) під час виконання трипортової ЗСВ 25+ з пілінгом ВПМ сітківки була здійснена ПРЛК, яку виконували на ендолазері PurePoint («Alcon», США), ендолазерним зондом 25 Ga. Параметри лазерної плями були вибрані відповідно до пігментації тканини сітківки до формування опіку середньої інтенсивності (2–3-го ступеня). Вони коливались у межах: потужність випромінювання 100–200 мВт, тривалість імпульсу 100–200 мс, інтервал 100–150 мс.
69 хворим (69 очей) було проведено факоемульсифікацію катаракти (ФЕК) в поєднанні із ЗСВ, пілінгом ВПМ та етапом ПРЛК. ФЕК виконували за стандартною методикою на апараті Constellation Vision System («Alcon», США) за допомогою касети Constellation TOTALPLUS комбінованої 7500СРМ, 25+ калібр («Alcon», США) через розрізи 2,65 та 2,2 мм. Імплантували інтраокулярну лінзу «Alcon» моделі SA60AT, ураховуючи її гідрофобні властивості.
У пацієнтів до хірургічного втручання було визначено сироватковий рівень TNFα методом імуноферментного аналізу з використанням набору реактивів (Bender Medsystems, Австрія). У ролі контрольної групи було залучено 95 осіб відповідної статі та віку, які не мали патології зору та ЦД2. У цій групі також дослідили TNFα крові. Імуноферментні дослідження виконували в Інституті клінічної і експериментальної медицини (директор – д-р мед. наук, професор Натрус Л. В.) Національного медичного університету імені О. О. Богомольця.
Усіх хворих обстежували через 1, 3, 6 і 12 місяців після операції. Визначали частоту рецидивів ДМП, у тому числі ДМН після хірургічного лікування, та їх зв’язок з рівнем TNFα крові до початку лікування.
Для статистичної обробки отриманих даних використовували програму Statistica 10 (StatSoft, Inc., USA). Після проведення тестів Колмогорова – Смірнова і χ-квадрат був встановлений відмінний від нормального характер розподілу варіаційних рядів (p < 0,05). У зв’язку з цим для описової статистики кількісних даних використовували медіану (Me) та перший і третій квартилі (Q1; Q3) варіаційних рядів. Для порівняння категоріальних змінних використовували таблиці сполучення і непараметричний критерій χ-квадрат Пірсона. У всіх випадках статистичного оцінювання значення р < 0,05 вважали вірогідними.
Результати та їх обговорення
Раніше в наших дослідженнях було встановлено, що частота рецидивів ДМП після різних видів хірургічного лікування загалом становила 29,7 %, по групах: у 1-й – 27,5 %, у 2-й – 22,8 % і в 3-й – 33,7 %.
Варіаційний статистичний аналіз показав, що розподіл значень вмісту у крові TNFα відрізнявся від нормального (тест Колмогорова – Смірнова р = 0,022; тест χ-квадрат p < 0,001). Тому аналіз проведено із застосуванням методів непараметричної статистики (множинні порівняння – критерій Kruskal – Wallis, парні – Mann – Whitney) (таблиця 1).
Таблиця 1. Уміст TNFα (пг/мл) у крові контрольної групи та 1, 2 та 3-й групах хворих; Me (Q1; Q3)

Примітка. Н – міжгрупові відмінності за критерієм Kruskal – Wallis (множинні порівняння);
р – вірогідність відмінностей міжгрупових порівнянь (приймається, якщо р < 0,05).
Загалом підвищення вмісту у крові TNFα спостерігали в усіх групах хворих, що відображено на рисунку 1. У 1-й групі хворих уміст TNFα перевищував контрольний в 1,2 раза (р = 0,005). У 2-й та 3-й групах уміст цитокіну прогресивно зростав порівняно з контролем у 2 і 3,4 раза відповідно (р < 0,001). Максимальний рівень TNFα був відзначений у хворих 3-ї групи, які мали ПДР, мінімальний – у хворих 1-ї групи при початковій НПДР.
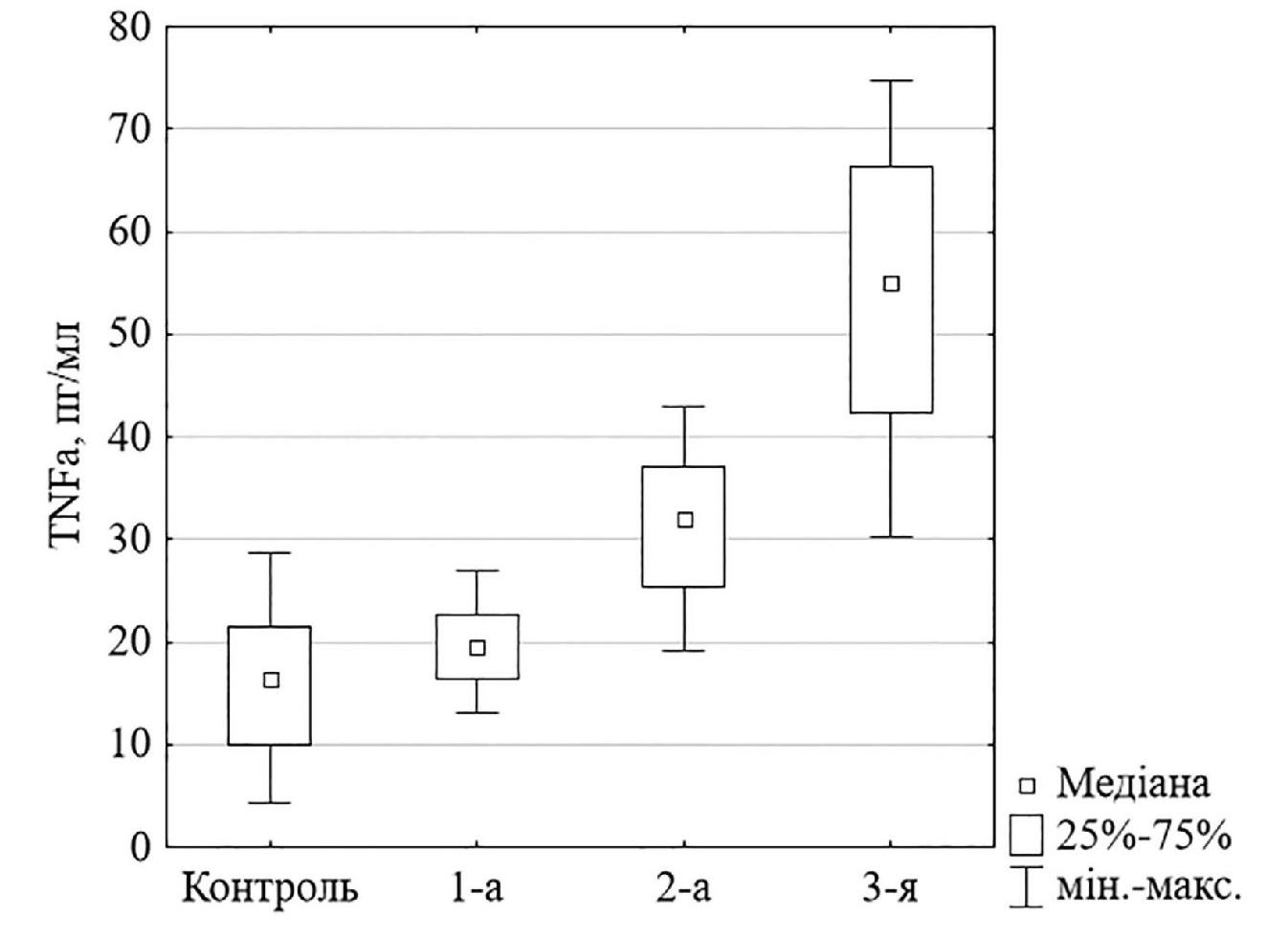
Рисунок 1. Уміст TNFα (пг/мл) у крові контрольної групи та 1, 2 та 3-ї груп хворих. Дані представлені як медіана, перший та третій квартилі (25%-75%); мінімальні (мін.) та максимальні (макс.) значення; при парних порівняннях за критерієм Mann – Whitney (U) різниця між контролем та 1-ю групою вірогідна при р = 0,005; між іншими групами – р < 0,001
За даними літератури, рівень цитокінів у склистому тілі пацієнтів з діабетичною ретинопатією, які перенесли задню вітректомію, був суттєво підвищеним, що особливо стосувалося хворих з ПДР [17, 18]. Саме при ПДР більшою мірою активізувалися компоненти сигнального прозапального комплексу – інфламасоми Pyrin domain 3 (NLRP3) [15]. Після оперативного втручання активність компонентів цього комплексу збільшувалася, що й обумовлювало патогенетичну роль прозапальних цитокінів та їх зв’язок з рецидивом ДМП. Важливість прозапальних цитокінів, поряд з ангіогенними, у розвитку ішемії сітківки за умов ЦД2 показано і в літературі [19].
Отже, отримані дані відповідають даним літератури – уміст TNFα пов’язаний із тяжкістю ретинопатії.
На наступному етапі нашого дослідження був встановлений зв’язок TNFα та його рівня у крові хворих із застосованим методом хірургічного втручання та рецидивами ДМП після них.
Уміст TNFα у групах хворих залежно від застосованого методу хірургічного лікування показав відповідність отриманих даних загальній тенденції: рівень циконіну поступово збільшувався від 1-ї до 3-ї групи, тобто від початкової НПДР до ПДР (таблиця 2).
Таблиця 2. Уміст TNFα (пг/мл) у крові 1, 2, 3-ї груп хворих; Me (Q1; Q3) 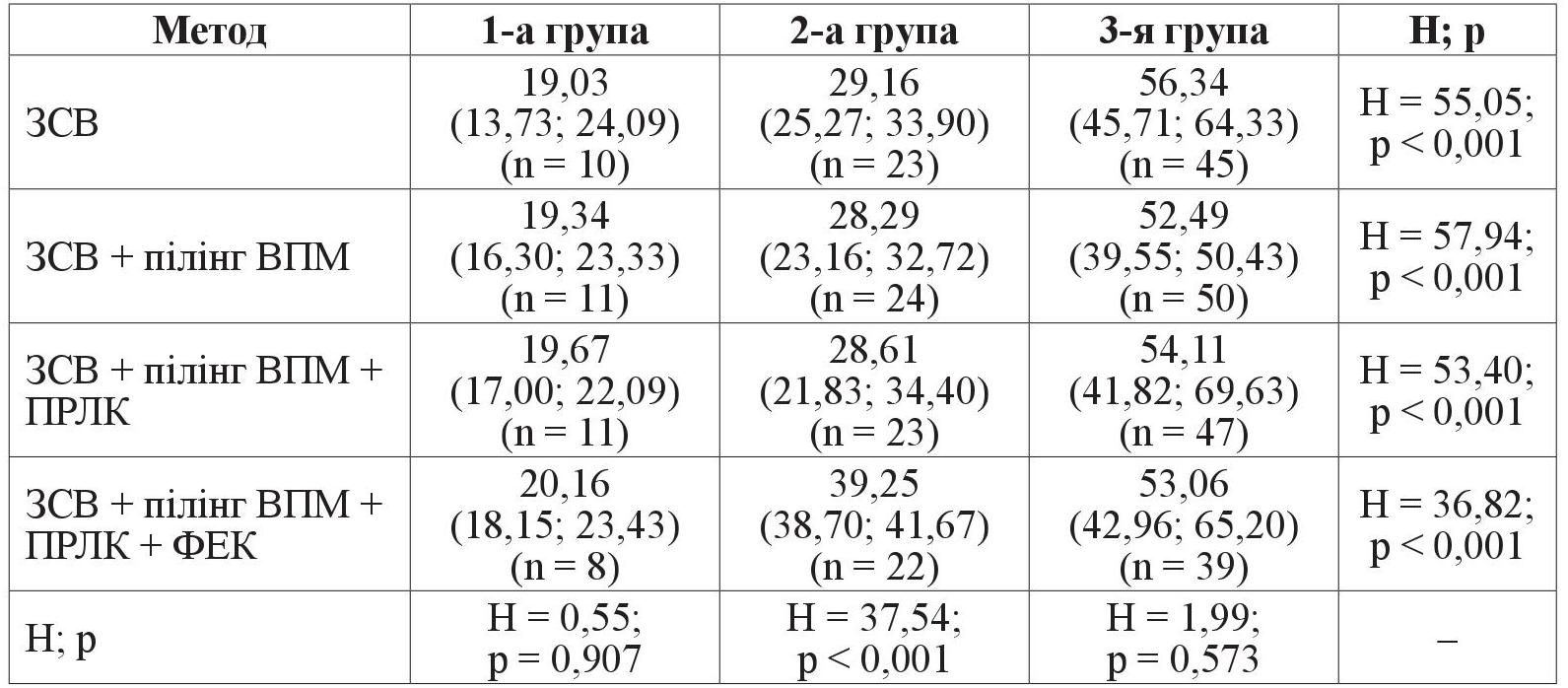
Примітка. Н – відмінності за критерієм Kruskal – Wallis (множинні порівняння);
р – вірогідність відмінностей міжгрупових порівнянь (приймається, якщо р < 0,05).
Початковий уміст TNFα в умовах цього дослідження не відрізнявся при різних методах хірургічного втручання. Також не було статистично значущої різниці між умістом TNFα у кожній з груп при різних методах лікування (р > 0,5). Виняток становив лише вміст цитокіну у 2-й групі при застосуванні всіх методів лікування (ЗСВ, пілінг ВПМ, ПРЛК і ФЕК), який був вищим за рівень при інших методах лікування цієї групи у 1,3–1,4 раза (р < 0,001). Очевидно, більша інтенсивність запальної реакції в таких хворих могла спричиняти й більшу експресію прозапального комплексу – інфламасоми Pyrin domain 3 (NLRP3) [15].
При аналізі зв’язку вмісту TNFα до хірургічного лікування з наявністю або відсутністю рецидивів ДМП у групах хворих встановлено, що у 1-й та 2-й групах за наявності рецидиву вміст цитокіну був значуще вищим, що було характерно для хворих з початковою НПДР (таблиця 3).
Таблиця 3. Уміст TNFα (пг/мл) у крові 1, 2, 3-ї груп хворих; Me (Q1; Q3) 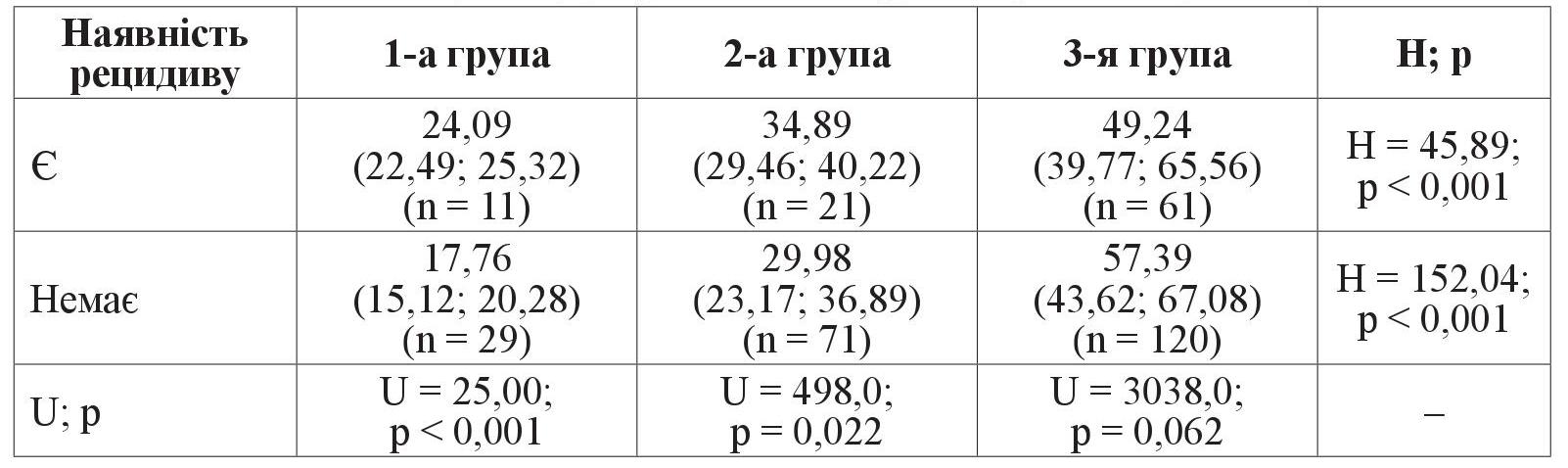
Примітка. Н – відмінності за критерієм Kruskal – Wallis (множинні порівняння);
U – відмінності за критерієм Mann – Whitney (парні порівняння);
р – вірогідність відмінностей міжгрупових порівнянь (приймається, якщо р < 0,05).
У 2-й групі різниця була менш значущою, тоді як у 3-й групі загалом ситуація змінювалася: медіана вмісту TNFα була вищою за відсутності рецидивів. Але при аналізі вибірки даних ставало очевидним, що розподіл даних суттєво не відрізнявся (р = 0,062) і діапазони даних фактично перекривалися.
Отримані нами результати показали, що збільшення вмісту в крові TNFα мало зв’язок з наявністю рецидивів тільки при НПДР, при ПДР значущого зв’язку вже не було. Це дозволило нам висловити припущення, що збільшення вмісту у крові TNFα могло бути пов’язане з рецидивом ДПМ після хірургічного лікування при початковій НПДР і меншою мірою при помірній та тяжкій НПДР і ПДР. Можливо, в останніх випадках на перший план виходили не протизапальні, а ангіогенні цитокіни, що узгоджувалось і з даними літератури [18].
У рамках цього дослідження ми зробили спробу диференціювати рецидиви за терміном. Усі рецидиви було поділено на три види: ранні перехідні – ті, що виникали на 1–3-му місяці та в подальшому зникали; ранні стійкі – ті, що виникали на 1–3-му місяці та потім лишалися на 6 місяців і 1 рік; пізні – ті, що виникали через 6 місяців і 1 рік. Було показано, що при застосуванні ЗСВ, а також при застосуванні ЗСВ, пілінгу ВПМ, ПРЛК і ФЕК всі рецидиви були ранніми, з яких більшість (77,3 % і 80 % відповідно) мали стійкий характер. У разі застосування ЗСВ з пілінгом ВПМ, а також при застосуванні ЗСВ, пілінгу ВПМ і ПРЛК більшість рецидивів відносили до ранніх стійких та пізніх (відповідно 91,3 % та 95,7 %).
При порівнянні вмісту TNFα у крові між групами було встановлено, що у 1-й групі істотної різниці не виявлено, хоча треба було відзначити невелику кількість спостережень при такому поділі хворих у цій групі (n = 11) (таблиця 4).
Таблиця 4. Уміст TNFα (пг/мл) крові в 1, 2, 3-й групах хворих; Me (Q1; Q3)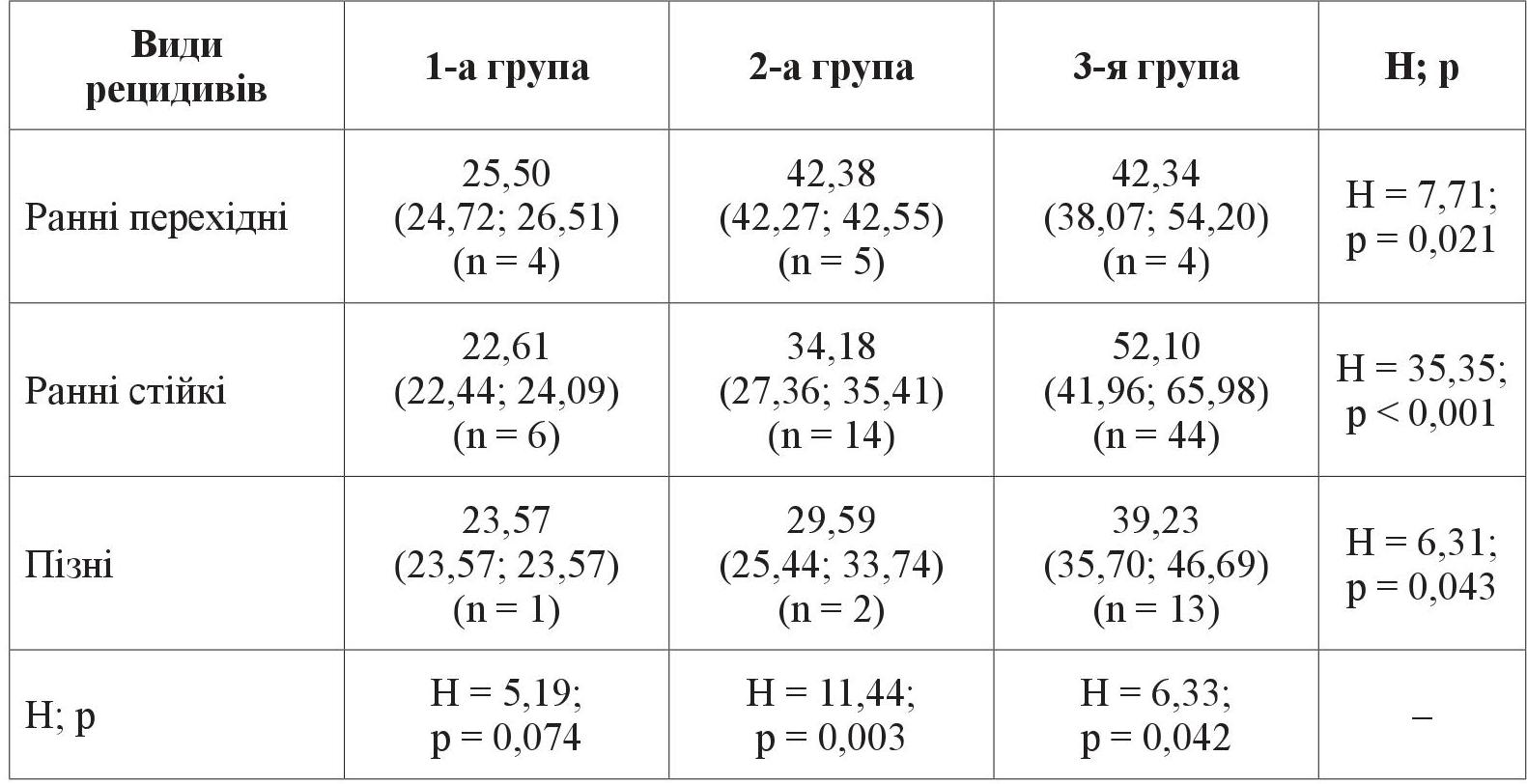
Примітка. Н – відмінності за критерієм Kruskal – Wallis (множинні порівняння);
р – вірогідність відмінностей міжгрупових порівнянь (приймається, якщо р < 0,05).
У 2-й групі найбільші значення вмісту TNFα в крові спостерігалися при ранніх перехідних і ранніх стійких рецидивах (р = 0,003), що могло відображати зв’язок більшої вираженості запальних процесів заднього відрізка ока до операції з характером рецидивів. У 3-й групі тенденція була аналогічною – більший рівень цитокіну при ранніх рецидивах з максимумом – при ранніх стійких (р = 0,042); крім того, й абсолютний уміст TNFα був найбільшим порівняно з іншими групами, що відповідало загальній закономірності (p < 0,05).
Отже, такі результати підтвердили зв’язок більшого початкового вмісту у крові хворих із ЦД2 прозапального цитокіну TNFα з ранніми, особливо з ранніми та стійкими рецидивами ДМП після хірургічного лікування.
Більш ретельний аналіз зв’язку вмісту TNFα з методами лікування за наявністю або відсутністю рецидивів показав відсутність статистично значущої різниці (p > 0,1). Також не було виявлено значущих відмінностей між методами лікування за типами рецидивів (p > 0,3).
Висновки
1. У наших дослідженнях було встановлено збільшення вмісту TNFα у крові хворих з ДМП та ЦД2, особливо при помірній і вираженій НПДР та здебільшого при ПДР.
2. Рівень TNFα у крові хворих з ДМП та ЦД2 впливав на рецидив ДМП після хірургічного лікування незалежно від його виду.
3. Встановлено найбільший вплив вихідного рівня TNFα на виникнення ранніх і стійких рецидивів ДМП після різних видів вітреоретинальних втручань.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
REFERENCES
- Пасечникова НВ, Сук СА, Кузнецова ТА, Пархоменко ОГ. Диабетическая макулопатия. Современные аспекты патогенеза, клиники, диагностики, лечения. Киев: Карбон ЛТД; 2010. Pasyechnikova NV, Suk SA, Kuznecova TA, Parkhomenko OG. [Diabetic maculopathy. Modern aspects of pathogenesis, clinic, diagnosis, treatment]. Kyiv; 2010. Russian.
- Diep TM, Tsui I. Risk factors associated with diabetic macular edema. Diabetes Res Clin Practice. 2013 Jun;100(3):298–305.
- Kamoi K. Identifying risk factors for clinically significant diabetic macula edema in patients with type 2 diabetes mellitus. Curr Diabetes Rev. 2013 May;9(3):209–17.
- Jenkins AJ, Joglekar MV, Hardikar AA, et al. Biomarkers in Diabetic Retinopathy. Rev Diabet Stud. 2015 Spring-Summer;12(1–2):159–95.
- Eshaq RS, Aldalati AMZ, Alexander JS, Harris NR. Diabetic retinopathy: Breaking the barrier. Pathophysiology. 2017;24(4):229–41. https://doi.org/10.1016/j.pathophys.2017.07.001
- Liu C, Feng X, Li Q, et al. Adiponectin, TNF-α and inflammatory cytokines and risk of type 2 diabetes: A systematic review and meta-analysis. Cytokine. 2016 Oct;86:100–9. https:// doi.org/10.1016/j.cyto.2016.06.028
- IRS1 – Insulin receptor substrate 1 – Homo sapiens (Human) – IRS1 gene & protein». www. uniprot.org. Retrieved 2016-04-21.
- Takaguri A. [Elucidation of a new mechanism of onset of insulin resistance: effects of statins and tumor necrosis factor-α on insulin signal transduction]. Yakugaku Zasshi. 2018;138(11): 1329–34. https://doi.org/10.1248/yakushi.18-00116. Japanese.
- Copps KD, White MF. Regulation of insulin sensitivity by serine/threonine phosphorylation of insulin receptor substrate proteins IRS1 and IRS2. Diabetologia. 2012;55(10):2565–82. https://doi.org/10.1007/s00125-012-2644-8
- Балашевич ЛИ, Измайлов АС. Диабетическая офтальмопатия. СПб.: Человек; 2012. Balashevich LI, Izmaylov AS. [Diabetic ophthalmopathy]. St. Petersburg; 2012. Russian.
- Xiao K, Dong YC, Xiao XG, et al. Effect of Pars Plana Vitrectomy With or Without Cataract Surgery in Patients with Diabetes: A Systematic Review and Meta-Analysis. Diabetes Ther. 2019;10(5):1859–68. https://doi.org/10.1007/s13300-019-0672-9
- Панченко ЮО, Могілевський СЮ. Вплив вітреоретинальних втручань на клінічний перебіг діабетичної макулопатії у хворих на цукровий діабет 2-го типу. Архів офтальмології України. 2019;7(1):68–73. Panchenko IuO, Mogilevskyy SIu. [Effects of vitreoretinal operations on clinical picture of diabetic maculopathy in patients with type 2 diabetes mellitus]. Archive Of Ukrainian Ophthalmology. 2019;7(1):68–73. Ukrainian. https://doi.org/10.22141/2309-8147.7.1.2019.163011
- Panchenko Yu. Possibilities and effectiveness of cataract phacoemulsifcation, closed subtotal vitrectomy and panretinal laser coagulation in diabetic maculopathy treatment in patients with type 2 diabetes. East European Science Journal. 2019;7 (47 part 2):50–6.
- Могілевський СЮ, Панченко ЮО, Зябліцев СВ. Прогнозування ризику діабетичного макулярного набряку при діабетичній ретинопатії у хворих на цукровий діабет 2 типу. Офтальмол. журн. 2019;3:3–8. Mogilevskyy SYu, Panchenko IuO, Ziablitsev SV. [Predicting the risk of diabetic retinopathy associated macular edema in patients with type 2 diabetes mellitus]. J.ophthalmol. 2019;3:3–8. Ukrainian. http://doi.org/10.31288/oftalmolzh2019338
- Loukovaara S, Piippo N., Kinnunen K., et al. NLRP3 inflammasome activation is associated with proliferative diabetic retinopathy. Acta Ophthalmol. 2017 Dec;95(8):803–8. https:// doi.org/10.1111/aos.13427
- Рыков СА, Могилевский СЮ, Пархоменко ОГ, Сук СА. Усовершенствованный алгоритм анализа снимков оптической когерентной томографии макулярной области сетчатки при диабетическом макулярном отёке. Арх. офтальмол Укр. 2015;3(1(3)):40–7. Rykov SA, Mogilevskiy SY, Parkhomenko OG, Suk SA. [Improved Algorithm of Analysis of Optical Coherence Tomography Images of Macula in Diabetic Macular Edema]. Archive of Ukrainian Ophthalmology. 2015;3(1(3)):40–7. Russian.
- Raczyńska D, Lisowska KA, Pietruczuk K, et al. The Level of Cytokines in the Vitreous Body of Severe Proliferative Diabetic Retinopathy Patients Undergoing Posterior Vitrectomy. Curr Pharm Des. 2018;24(27):3276–81. https://doi.org/10.2174/1381612824666180926110704
- Boss JD, Singh PK, Pandya HK, et al. Assessment of Neurotrophins and Inflammatory Mediators in Vitreous of Patients With Diabetic Retinopathy. Invest Ophthalmol Vis Sci. 2017 Oct 1;58(12):5594–603. https://doi.org/10.1167/iovs.17-21973
- Kovacs K, Marra KV, Yu G, et al. Angiogenic and Inflammatory Vitreous Biomarkers Associated With Increasing Levels of Retinal Ischemia. Invest Ophthalmol Vis Sci. 2015 Oct; 56(11):6523–30. https://doi.org/10.1167/iovs.15-16793
Стаття надійшла в редакцію 02.09.2019 р.
Рецензія на статтю надійшла в редакцію 03.10.2019 р.