- Автор: Super User
- Категорія: №2 (10) 2019
- Опубліковано: 28 грудня 2019
- Перегляди: 3794
УДК 617.7–007.681:577.19–07
https://doi.org/10.30702/Ophthalmology.2019/10.1487106
Cердюк В. Н.1, д-р мед. наук, профессор кафедры офтальмологии
Устименко С. Б.2, и. о. директора
Кушнир Н. Н.2, канд. мед. наук, врач-офтальмолог
Максимова И. Р.2, врач-офтальмолог
1ГУ «Днепропетровская медицинская академия МОЗ Украины», г. Днепр, Украина
2КУ «Днепропетровская областная клиническая офтальмологическая больница», г. Днепр, Украина
Резюме. Представлены результаты долгосрочного наблюдения (2011–2019 гг.) 64 пациентов (106 глаз) в возрасте от 59 до 79 лет с ІІ и ІІІ стадиями первичной открытоугольной глаукомы (ПОУГ). Для оценки течения нейродегенеративного процесса проанализированы показатели MD, PSD, Vrim, GCC, GLV, FLV, а также латентность и амплитуда ранних компонентов зрительных вызванных потенциалов. Наиболее высокая эффективность прямой нейропротекции выявлена для ІІ стадии ПОУГ при монотерапии с цитиколином, а для ІІІ стадии ПОУГ – при комбинированной терапии с цитиколином и мемантином. При долгосрочном наблюдении результаты нейропротекторной монотерапии с мемантином практически не отличались от традиционного лечения. Полученные результаты свидетельствуют о замедлении прогрессирования глаукоматозной оптической нейропатии по всем объективным показателям в 2–2,5 раза у пациентов, которые получали комбинированную нейропротекторную терапию цитиколином и мемантином, по сравнению с больными, получавшими традиционную терапию.
Ключевые слова: первичная открытоугольная глаукома, нейропротекция, глаукомная оптическая нейропатия, цитиколин, мемантин.
Serdiuk V.1, Ustymenko S.2, Kushnir N.2, Maksymova I.2
1Dnipropetrovsk Medical Academy of the Ministry of Health of Ukraine, Dnipro, Ukraine
2Dnipropetrovsk Regional Ophthalmological Clinical Hospital, Dnipro, Ukraine
Our Results of the Use of Direct Neuroprotection in the Complex Treatment of Glaucomatous Optical Neuropathy in Patients with Primary Open-Angle Glaucoma from 2011 to 2019
Abstract
Materials and methods. Under observation there were 64 patients (106 eyes) aged 59 to 79 years; of which 39 are men and 25 are women. Depending on the stage of primary open-angle glaucoma (POAG), patients are divided into two groups that are comparable by age, gender and clinical condition – 34 patients (53 eyes) with 2 stages of POAG and 30 patients (53 eyes) with 3 stages of POAG. A prerequisite for inclusion in the study is the stabilization of IOP.
As direct neuroprotection drugs, citicoline and memantine were used.
To assess the course of the neurodegenerative process for the period from 2011 to 2019 The perimetric indices of MD and PSD, morphological characteristics according to optical coherence tomography – Vrim, GCC, GLV, FLV, as well as latency and amplitude of the early components of visual evoked potentials were analyzed.
Results. The highest efficiency of direct neuroprotection was found for stage 2 of POAG with monotherapy with citicoline, and for stage 3 of POAG with combination therapy with citicoline and memantine. At long-term follow-up, the results of neuroprotective monotherapy with memantine were practically the same as traditional treatment. The obtained results demonstrated a slowdown in the progression of glaucomatous optical neuropathy in all objective indicators by 2–2.5 times in patients who received combined neuroprotective therapy – citicoline and memantine, compared with patients who received conventional therapy.
Keywords: рrimary open-angle glaucoma, neuroprotection, optiс neuropathy, citicoline, memantine.
Актуальность
По данным ВОЗ, в мире проживает около 314 млн слабовидящих. Больные глаукомой составляют более 2 % от этого числа.
В свете современных представлений первичная открытоугольная глаукома (ПОУГ) рассматривается как мультифакторное заболевание с пороговым эффектом, которое приводит к глаукоматозной оптической нейропатии (ГОН). Индуцирующим фактором в патогенезе глаукомы, согласно метаболической концепции, является окислительный стресс и эксайтотоксическое повреждение третьего нейрона сетчатки. Важная роль также принадлежит патологическим процессам с участием активированной нейроглии, продуцирующей в условиях гипоксии большое количество токсических метаболитов, которые оказывают повреждающее действие на нейроны сетчатки и аксоны зрительного нерва. Феномен эксайтотоксичности принято считать одним из наиболее важных метаболических нарушений, которые лежат в основе апоптоза ганглиозных клеток сетчатки (ГКС) при ГОН [1–3].
В проведенных ранее исследованиях нами было выявлено, что в условиях моделирования глаукоматозного процесса отмечается резкое увеличение уровня глутамата в тканях сетчатки и зрительного нерва – на 75,2 % [4]. Глутамат является основным нейромедиатором центральной нервной системы и сетчатки. В то же время повышение концентрации глутамата выше физиологического уровня вызывает в сетчатке блокаду межнейрональной передачи нервных импульсов и сочетается с селективным апоптозом ганглионарных клеток сетчатки из-за нейротоксического действия глутамата [5–7].
Было показано, что включение комбинации нейротропных препаратов в комплексное лечение больных с ПОУГ – неконкурентного антагониста глутаматных NMDA-рецепторов мемантина и ноотропного препарата цитиколина – способствовало достоверному снижению уровня глутамата во влаге передней камеры (на 22,9 %) и слезной жидкости (на 25 %) по сравнению с традиционным лечением (p < 0,001) [4]. Проведенные нами клинико-биохимические и экспериментальные исследования продемонстрировали, что в механизме позитивного влияния указанных препаратов на состояние оксидативного повреждения белков и липидов важная роль принадлежит их регулирующему влиянию на ферменты антиоксидантной системы в процессе развития глаукоматозного процесса [8].
Нейропротекторная терапия глаукомы направлена на предотвращение каскада реакций, приводящих к поражению нейронов сетчатки и зрительного нерва, вызванного преимущественно ишемией, то есть предназначена для предотвращения необратимой гибели ганглиозных клеток сетчатки [9, 10]. Изучение эффективности патогенетически ориентированной терапии, направленной на стабилизацию метаболических нарушений и профилактику прогрессирования ГОН у больных с ПОУГ, является актуальной проблемой современной офтальмологии.
Цель работы
Оценить эффективность применения препаратов прямой нейропротекции в комплексном лечении глаукоматозной оптической нейропатии у больных с первичной открытоугольной глаукомой за последние 8 лет наблюдения.
Материалы и методы
Под наблюдением было 64 пациента (106 глаз) в возрасте от 59 до 79 лет, из них 39 мужчин и 25 женщин. В зависимости от стадии ПОУГ пациенты разделены на две группы, сопоставимые по возрасту, полу и клиническому состоянию. В первую группу вошли 34 пациента (53 глаза) со ІІ стадией ПОУГ. Вторую группу составили больные с ІІІ стадией ПОУГ – 30 пациентов (53 глаза). Критерий включения в исследование – стабилизация внутриглазного давления (ВГД).
В каждой группе пациенты распределены в подгруппы в зависимости от вида лечения: 1) нейропротекторная комбинированная терапия – цитиколин и мемантин; 2) монотерапия – цитиколин; 3) монотерапия – мемантин; 4) традиционная терапия.
Цитиколин – препарат, который ингибирует апоптоз, связанный с церебральной ишемией, обеспечивает профилактику развития феномена эксайтотоксичности, блокируя выброс глутамата, играющего ведущую роль в деструкции нейрональных мембран, является донором холина для синтеза ацетилхолина, активирует биосинтез фосфолипидов в мембранах нейронов, улучшает мозговой метаболизм [9]. Ингибитор фосфолипаз и стабилизатор клеточных мембран. Мемантин – антагонист NMDA-рецепторов, блокирующий резкий подъем концентрации глутамата, оказывает модулирующее действие на глутаматергическую систему, регулирует ионный транспорт, блокирует кальциевые каналы и улучшает процесс передачи нервного импульса.
Традиционная терапия включала: метилэтилпиридинол гидрохлорид (эмоксипин), депротеинизированный гемодериват (солкосерил), нандролон деканоат (ретаболил), комплекс витаминов В1, В6, В12 (мильгамма), пирацетам и циннаризин (фезам).
Для оценки течения нейродегенеративного процесса проанализированы объективные показатели ГОН – MD (cреднее отклонение измеренных пороговых значений светочувствительности от нормальных скорректированных по возрасту значений), PSD (разброс стандартного отклонения или количество локальных дефектов), Vrim (объем нейроретинального ободка), RNFL (толщина слоя нервных волокон), GCC (толщина комплекса ганглионарных клеток), GLV (глобальные потери ганглионарных клеток), FLV (фокальные потери ганглионарных клеток) [11].
Также исследовали косвенный показатель ГОН – зрительные вызванные потенциалы (ЗВП) – суммарный ответ больших популяций нейронов коры головного мозга на приходящий к ним синхронный поток импульсов, возникающий под действием афферентного раздражителя, который отображает функциональное состояние зрительного анализатора. Метод позволяет осуществить количественную оценку данных проведенного исследования.
Нами применялся метод регистрации ЗВП на вспышку, позволяющий определить амплитуду (А в мкВ) и латентность (t в мс) всех показателей ЗВП-кривой, характеризующих разные уровни корковых ответов мозга. Оценивали показатели ранних корковых ответов зрительных центров – латентность пиков N0, Р1, N1 и амплитуду Р1–N1 [12–14].
Статистический анализ полученных результатов выполнен с использованием дисперсионного анализа ANOVA (в случае нормального закона распределения) и критерия Крускала – Уоллиса (в случае закона распределения отличного от нормального).
Результаты
За 8-летний период наблюдения отмечалась отрицательная динамика изменений всех показателей, которые характеризуют ГОН. Обращает внимание отличие изменения показателя PSD при долгосрочном наблюдении у пациентов со ІІ и ІІІ стадиями ПОУГ. Во ІІ стадии наблюдается увеличение значений показателя, что отражает накопление локальных дефектов поля зрения (таблица 1).
Таблица 1. Изменение показателей периметрии за период с 2011 по 2019 год у пациентов с ПОУГ ІІ стадии 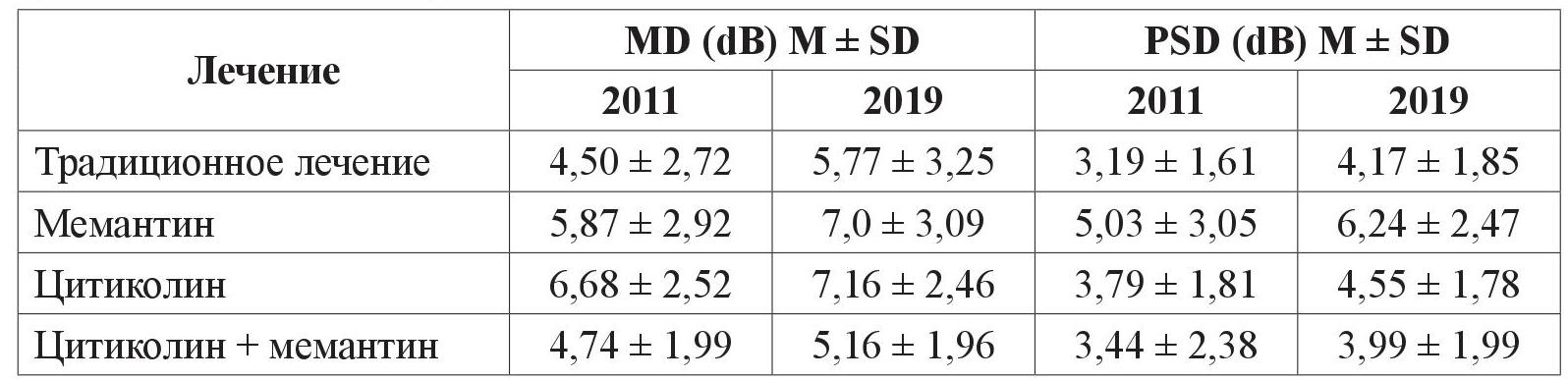
А у больных с ІІІ стадией ПОУГ этот показатель прогрессивно уменьшается, что можно объяснить слиянием локальных дефектов с формированием тотальной депрессии светочувствительности (таблица 2).
Таблица 2. Изменение показателей периметрии за период с 2011 по 2019 год у пациентов с ПОУГ ІІІ стадии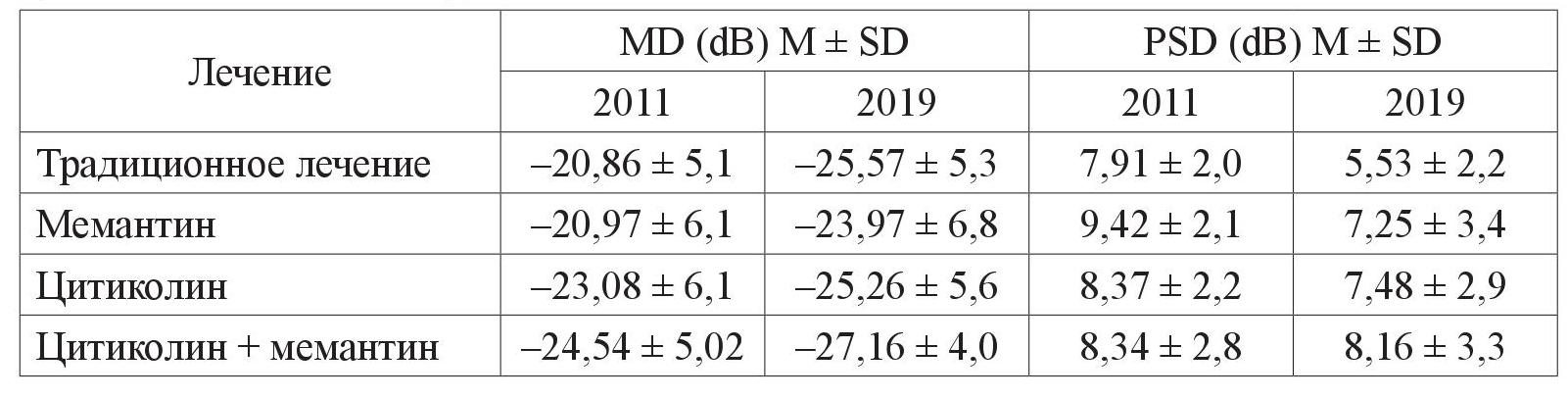
Количественная оценка прогрессирования ГОН продемонстрировала, что изменение объективных морфологических показателей ГОН за период с 2011 по 2019 год у пациентов с ПОУГ ІІ стадии, которые получали комбинацию нейропротекторных препаратов прямого действия, достоверно отличалось от изменения этих показателей у больных, получавших традиционное консервативное лечение: ΔVrim –0,006 (95 % доверительный интервал (ДИ) –0,008; –0,003) и –0,022 (95 % ДИ –0,024; –0,015), р = 0,004; ΔRNFL –6,2 (95 % ДИ –7,5; –4,9) и –13,8 (95 % ДИ –18,3; –11,8), р < 0,001; ΔGCC –8,2 (95 % ДИ –8,5; –7,2) и –10,70 (95 % ДИ –14,8; –8,2), р < 0,001; ΔGLV 1,51 (95 % ДИ 1,20; 1,82) и 2,60 (95 % ДИ 1,94; 3,27), р < 0,001; ΔFLV 0,86 (95 % ДИ 0,62; 1,20) и 2,44 (95 % ДИ 2,11; 3,53), р < 0,001 соответственно (таблица 3, рисунки 1–5).
Таблица 3. Изменение объективных показателей ГОН за период с 2011 по 2019 год у пациентов с ПОУГ ІІ стадии
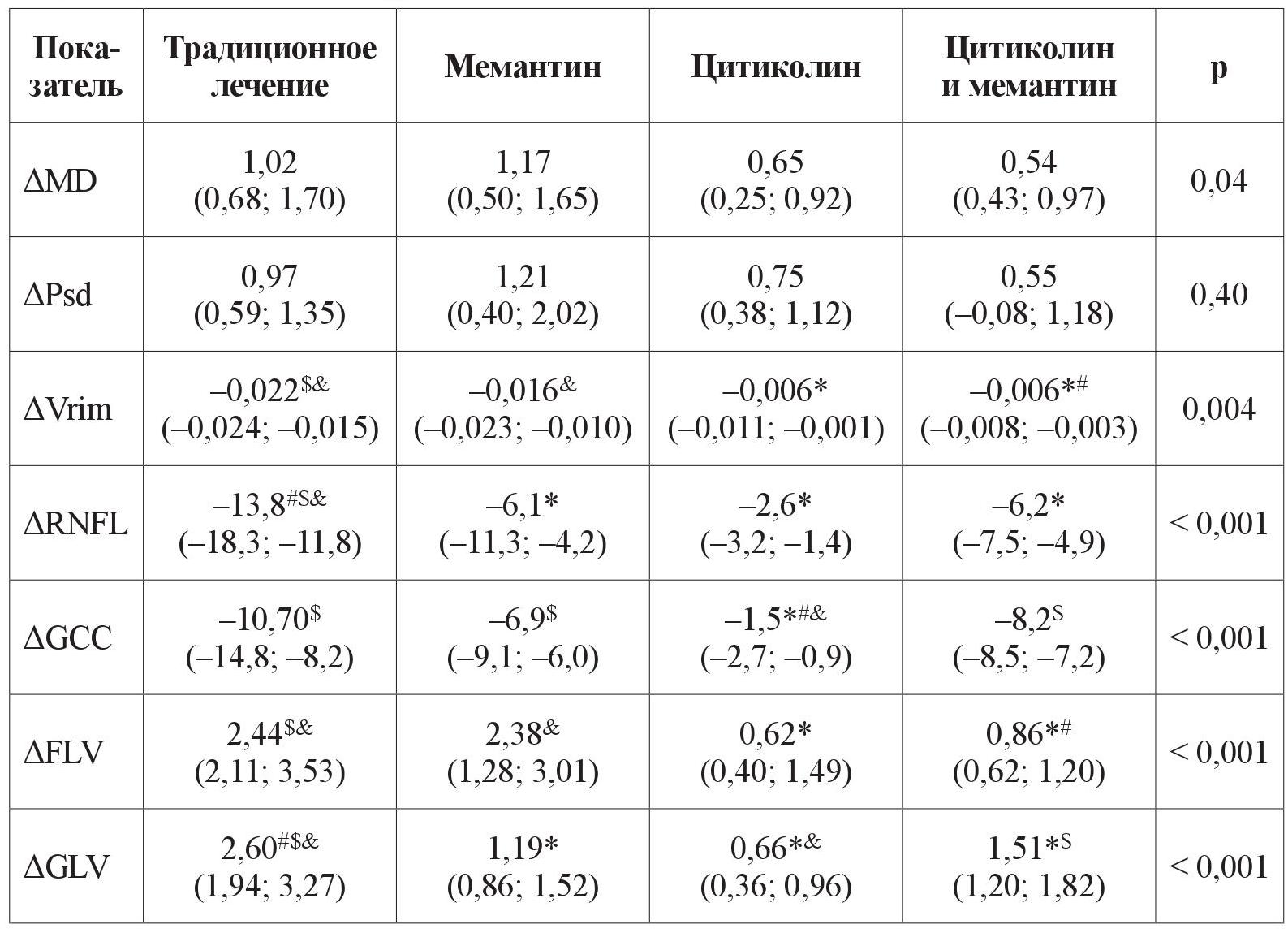
Примечание. р – уровень значимоcти отличия. Результаты представлены как (95 % ДИ) в случае нормального закона распределения либо Ме (95 % ДИ) в случае закона распределения, отличного от нормального.
* – отличие от изменения показателей группы традиционного лечения статистически значимо, p < 0,05;
# – отличие от изменения показателей группы мемантина статистически значимо, p < 0,05;
$ – отличие от изменения показателей группы цитиколина статистически значимо, p < 0,05;
& – отличие от изменения показателей группы цитиколина и мемантина статистически значимо, p < 0,05.
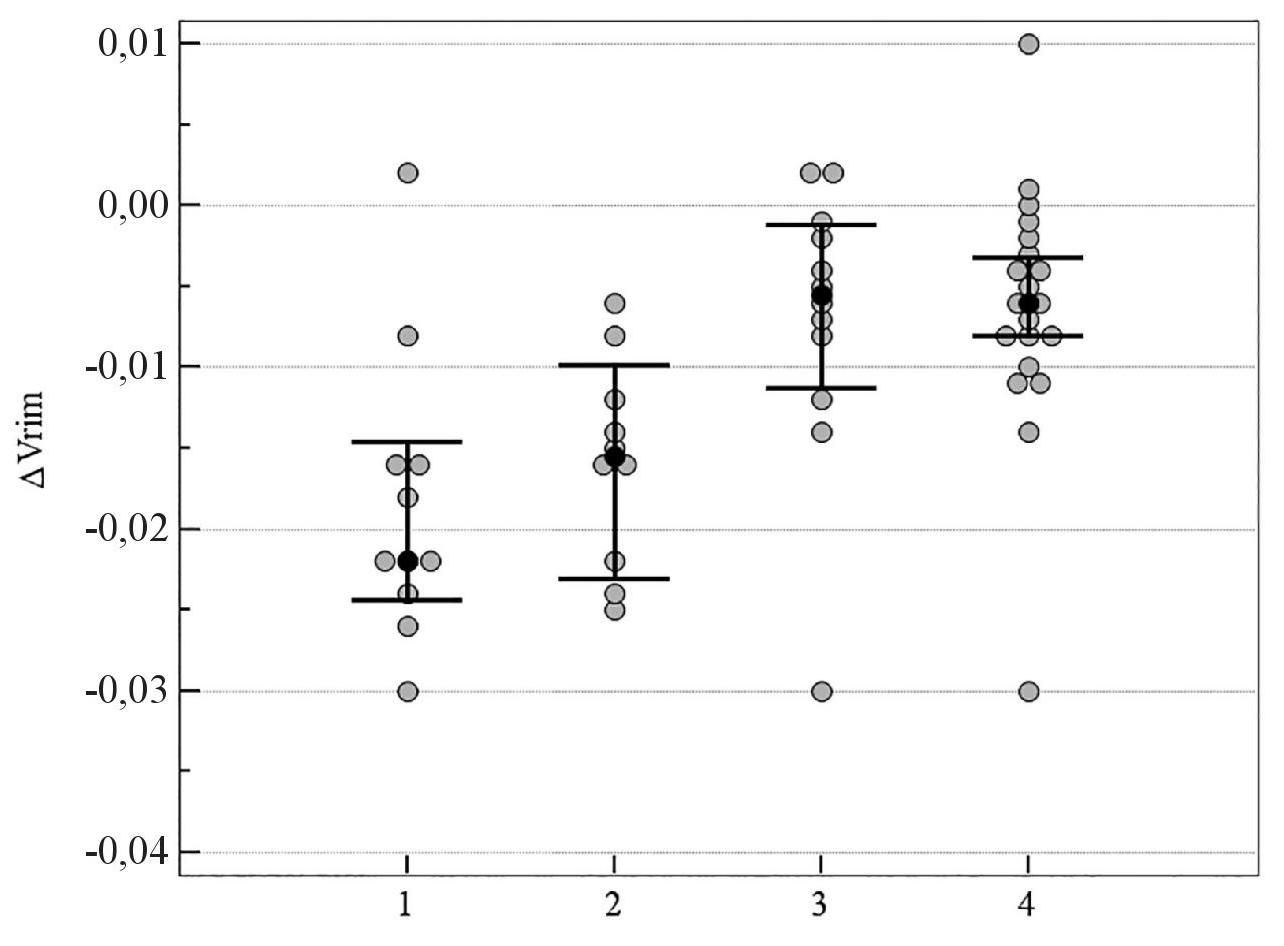
Рисунок 1. Медианное значение (95 % ДИ) изменения показателя Vrim у пациентов со ІІ стадией ПОУГ: 1 – традиционное лечение; 2 – мемантин; 3 – цитиколин; 4 – цитиколин и мемантин
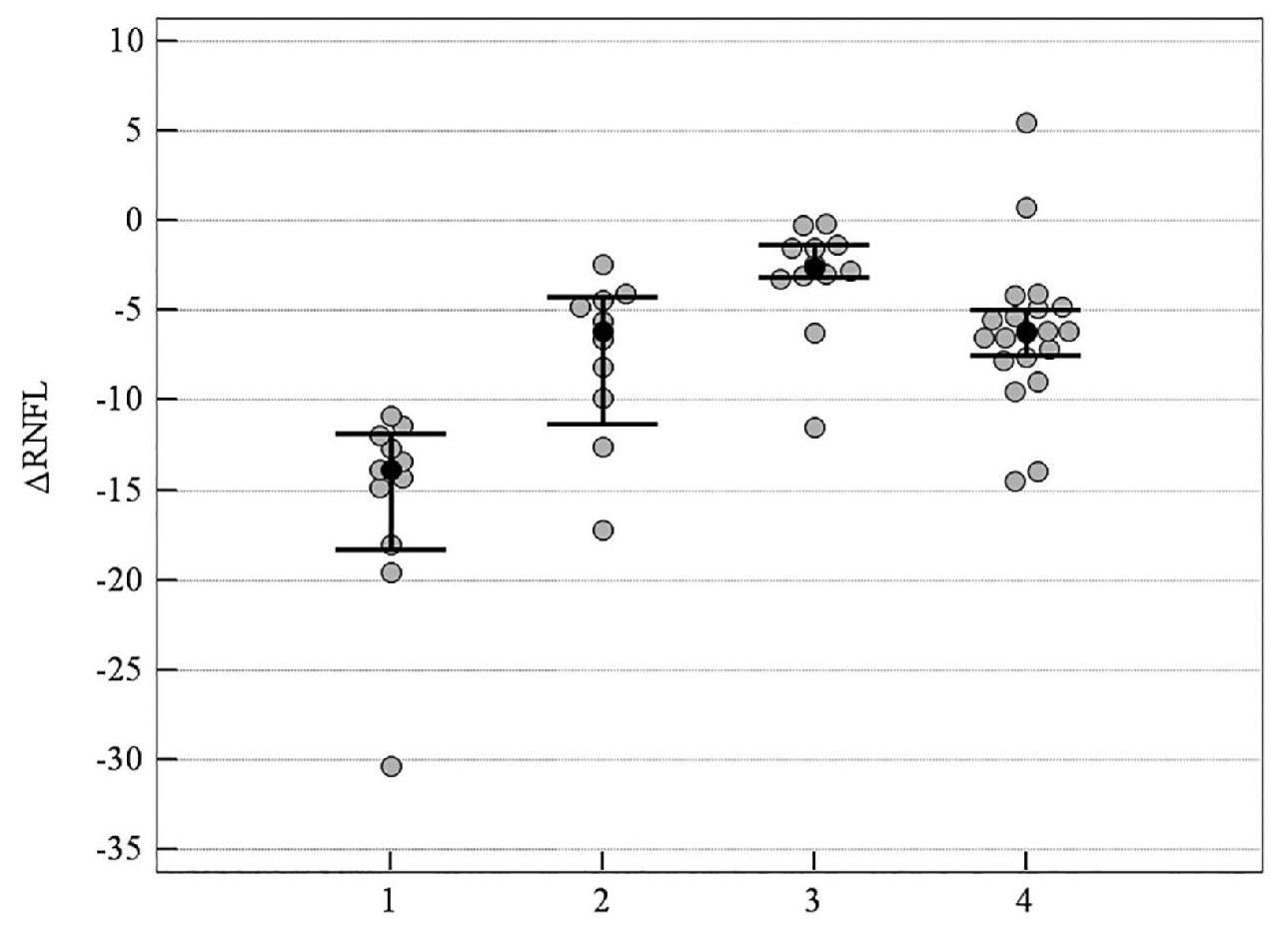
Рисунок 2. Медианное значение (95 % ДИ) изменения показателя RNFL у пациентов со ІІ стадией ПОУГ: 1 – традиционное лечение; 2 – мемантин; 3 – цитиколин; 4 – цитиколин и мемантин
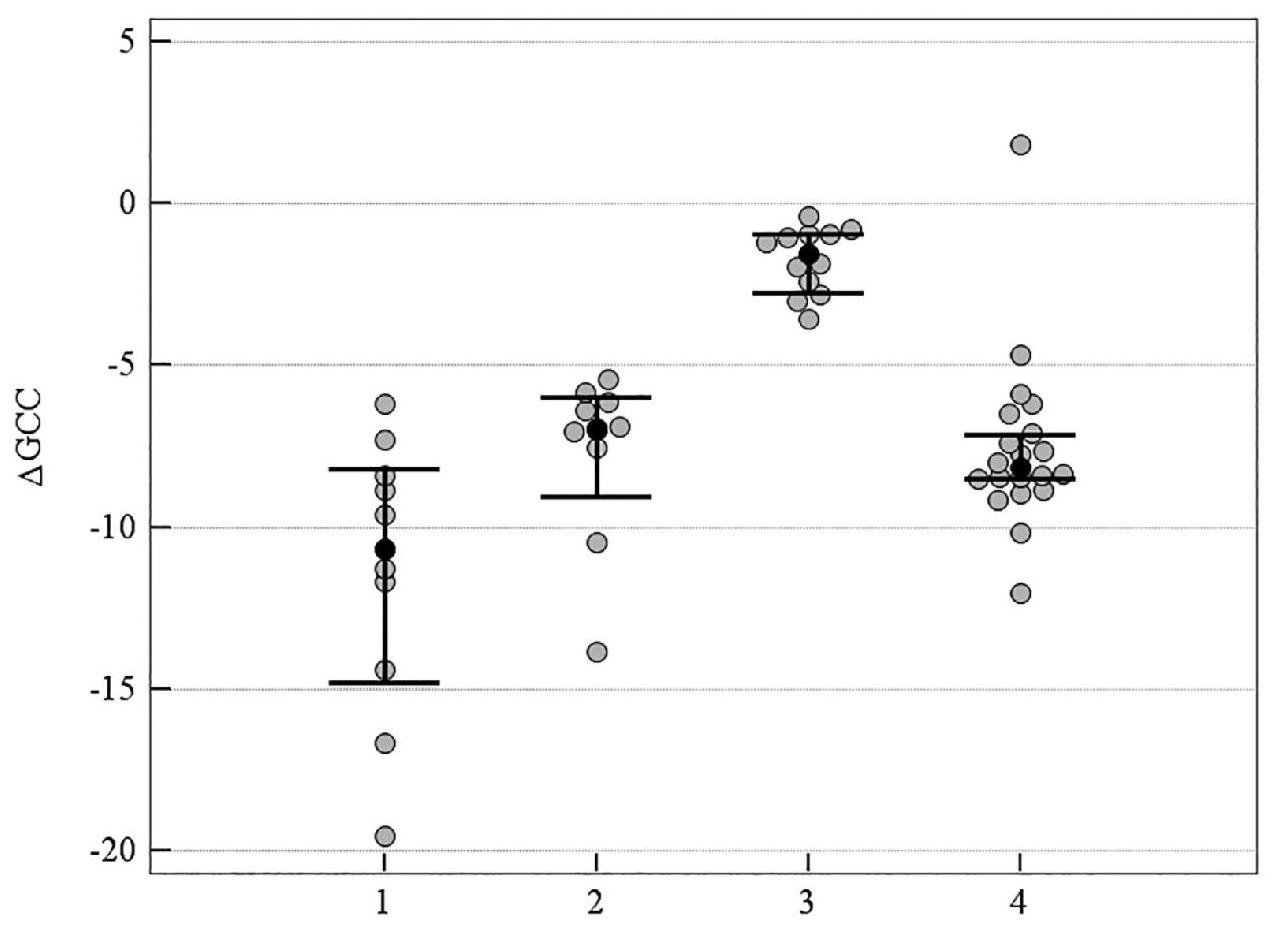
Рисунок 3. Медианное значение (95 % ДИ) изменения показателя GCC у пациентов со ІІ стадией ПОУГ: 1 – традиционное лечение; 2 – мемантин; 3 – цитиколин; 4 – цитиколин и мемантин
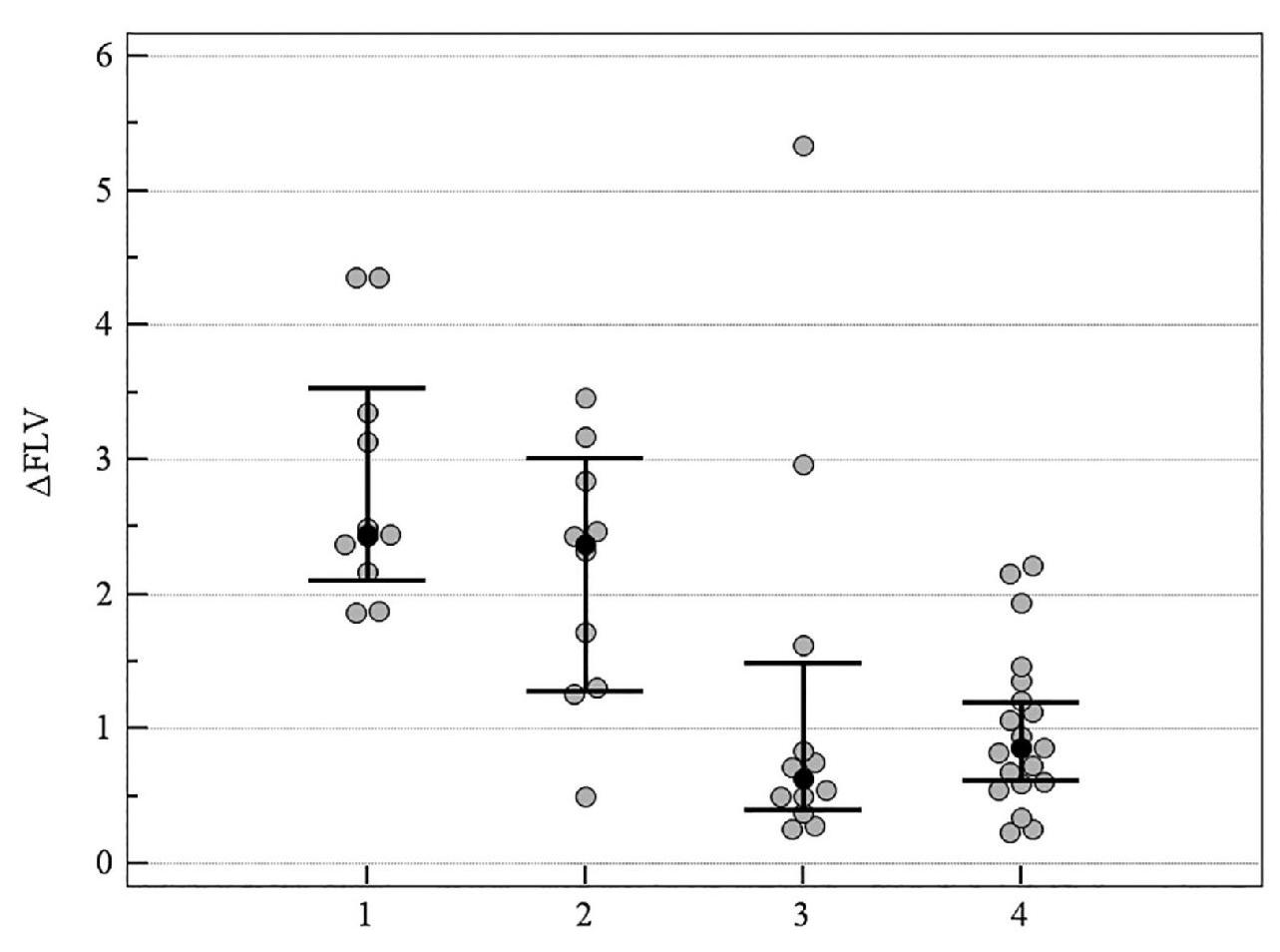
Рисунок 4. Медианное значение (95 % ДИ) изменения показателя FLV у пациентов со ІІ стадией ПОУГ: 1 – традиционное лечение; 2 – мемантин; 3 – цитиколин; 4 – цитиколин и мемантин
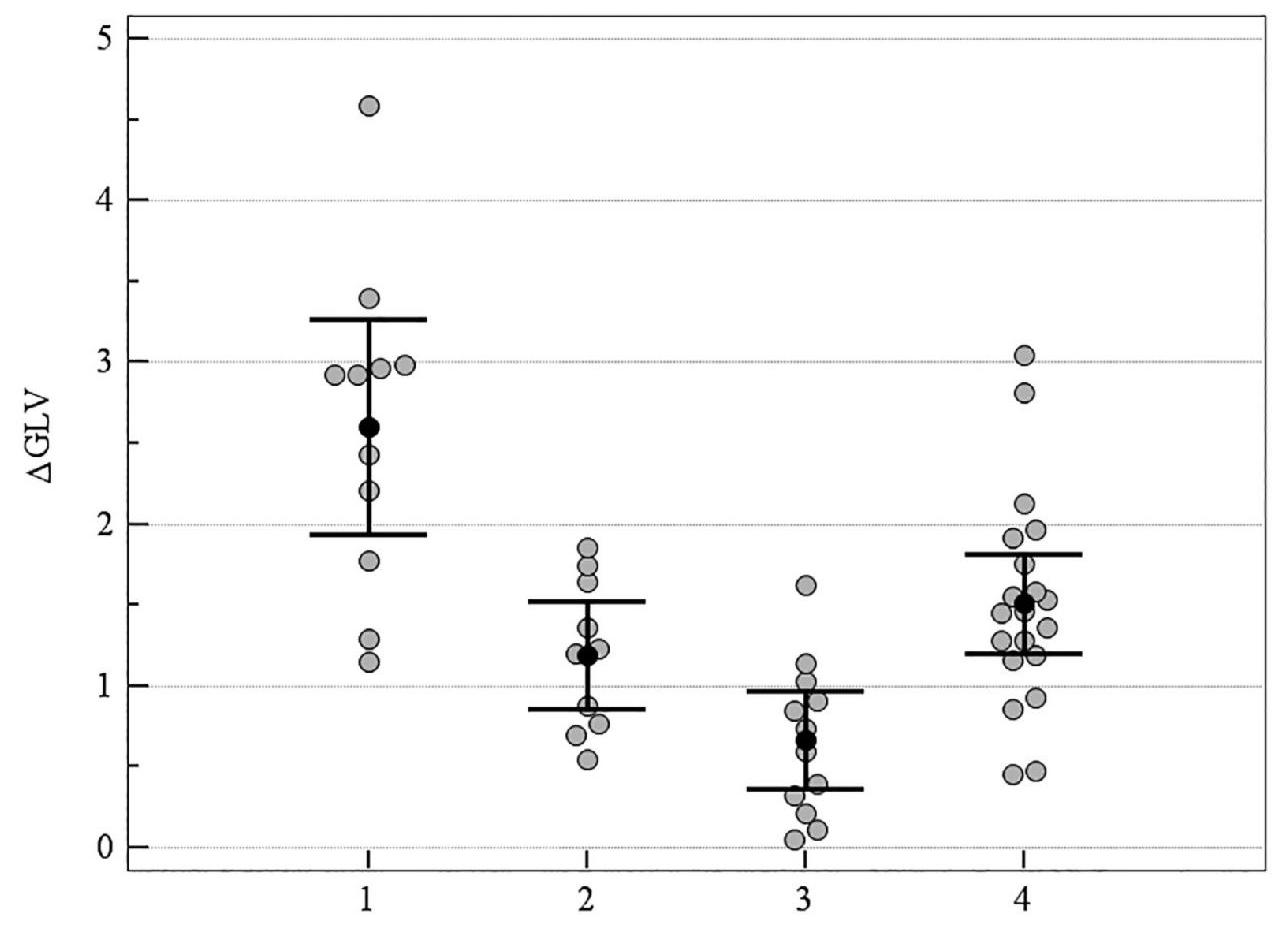
Рисунок 5. Медианное значение (95 % ДИ) изменения показателя GLV у пациентов со ІІ стадией ПОУГ: 1 – традиционное лечение; 2 – мемантин; 3 – цитиколин; 4 – цитиколин и мемантин
На рисунках 1–5 продемонстрировано медианное значение (95 % ДИ) изменения объективных морфологических показателей Vrim, RNFL, GCC, FLV, GLV за 8-летний период в группах пациентов с ІІ стадией ПОУГ, которые получали разную нейротропную терапию. Степень изменений всех морфологических показателей – Vrim, RNFL, GCC, FLV, GLV – была статистически значимо выражена в меньшей степени в группе монотерапии с цитиколином по сравнению с группой традиционного лечения. Изменения Vrim, RNFL, FLV, GLV также были статистически значимо в меньшей степени выражены в группе комбинированного лечения по сравнению с группой монотерапии с мемантином. Так, изменение показателя Vrim не отличалось у пациентов, которые принимали мемантин, от результатов группы, получавшей традиционное лечение. Отрицательная динамика изменений показателя Vrim была выражена в большей степени в группах, которые получали традиционное лечение или мемантин, в сравнении с группами, которым назначали комбинированную терапию или монотерапию с цитиколином (см. таблицу 3, рисунки 1–5).
Таким образом, при долгосрочном наблюдении (2011–2019 гг.), наиболее высокая эффективность прямой нейропротекции выявлена у пациентов со ІІ стадией ПОУГ при монотерапии с цитиколином. Результаты в группе нейропротекторной монотерапии с мемантином были подобны изменениям показателей, характеризующих течение ГОН в группе больных, получавших традиционное лечение (см. таблицу 3, рисунки 1–5).
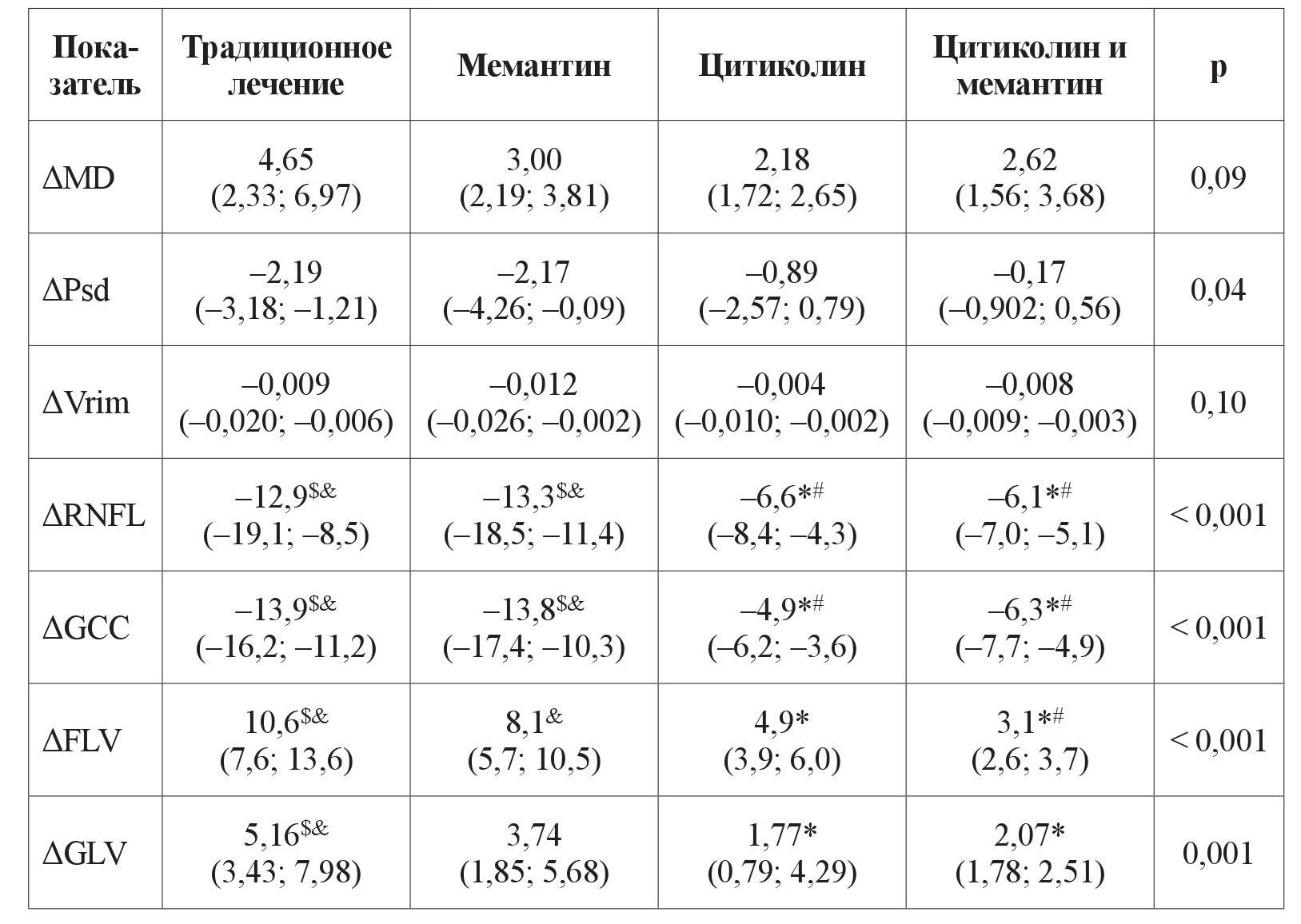
Аналогичная тенденция в прогрессировании ГОН наблюдалась у пациентов с ПОУГ ІІІ стадии. Изменение объективных морфологических показателей ГОН за период с 2011 по 2019 год у пациентов с ПОУГ ІІІ стадии, которые получали комбинацию нейропротекторных препаратов прямого действия, достоверно отличалось от изменения этих показателей у больных, получавших традиционное консервативное лечение: ΔRNFL –6,1 (95 % ДИ –7,0; –5,1) и –12,9 (95 % ДИ –19,1; –8,5), р < 0,001; ΔGCC –6,3 (95 % ДИ –7,7; –4,9) и –13,9 (95 % ДИ –16,2; –11,2), р < 0,001; ΔGLV 2,07 (95 % ДИ 1,78; 2,51) и 5,16 (95 % ДИ 3,43; 7,98), р = 0,001; ΔFLV 3,1 (95 % ДИ 2,6; 3,7) и 10,6 (95 % ДИ 7,6; 13,6), р < 0,001 соответственно (таблица 4, рисунки 6–9).
Таблица 4. Изменение объективных показателей ГОН за период с 2011 по 2019 год у пациентов с ПОУГ ІІІ стадии
Примечание. р – уровень значимоcти отличия. Результаты представлены как (95 % ДИ) в случае нормального закона распределения либо Ме (95 % ДИ) в случае закона распределения, отличного от нормального.
* – отличие от изменения показателей группы традиционного лечения статистически значимо, p < 0,05;
# – отличие от изменения показателей группы мемантина статистически значимо, p < 0,05;
$ – отличие от изменения показателей группы цитиколина статистически значимо, p < 0,05;
& – отличие от изменения показателей группы цитиколина и мемантина статистически значимо, p < 0,05.
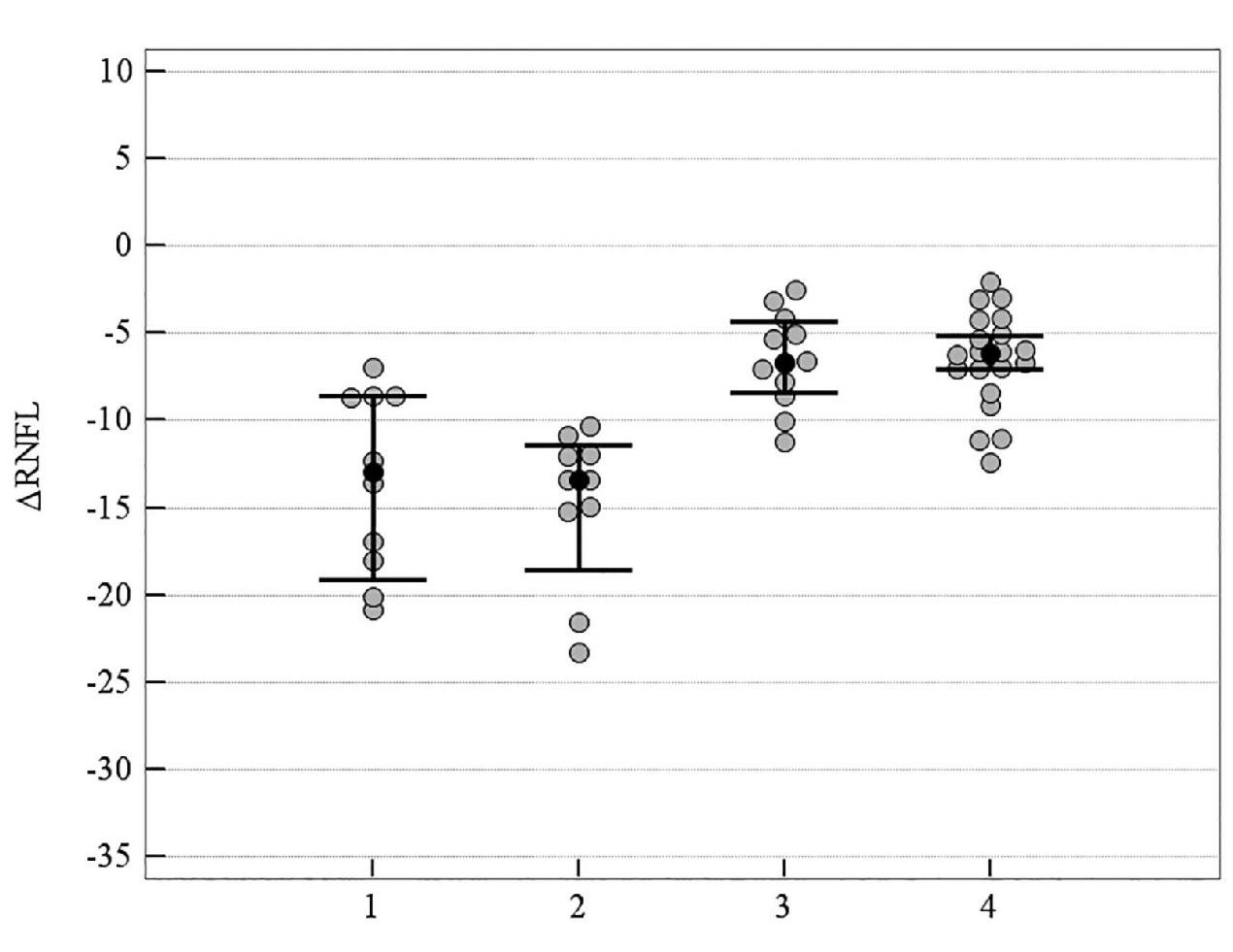
Рисунок 6. Медианное значение (95 % ДИ) изменения показателя RNFL у пациентов с ІІІ стадией ПОУГ: 1 – традиционное лечение; 2 – мемантин; 3 – цитиколин; 4 – цитиколин и мемантин
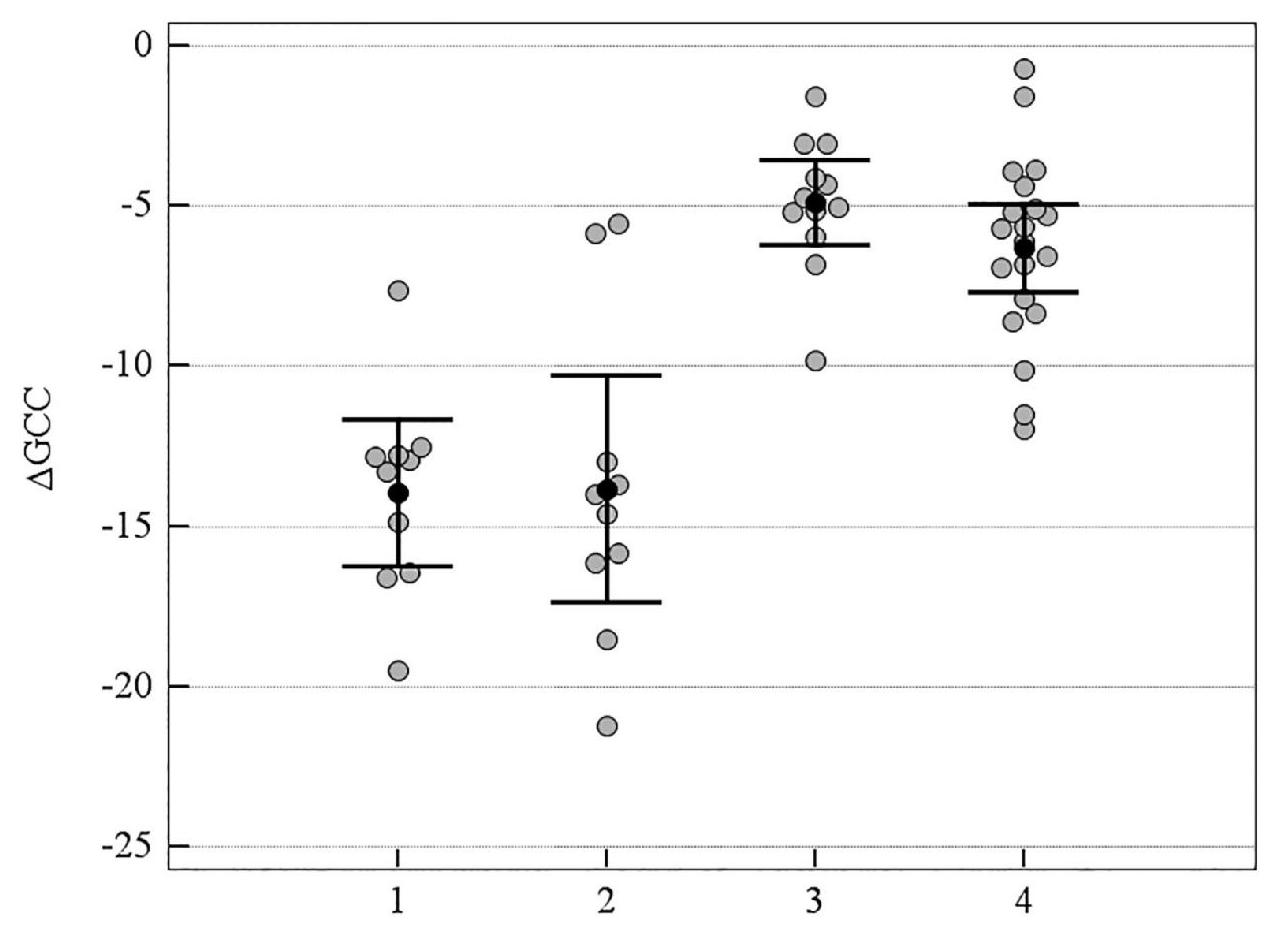
Рисунок 7. Медианное значение (95 % ДИ) изменения показателя GCC у пациентов с ІІІ стадией ПОУГ: 1 – традиционное лечение; 2 – мемантин; 3 – цитиколин; 4 – цитиколин и мемантин
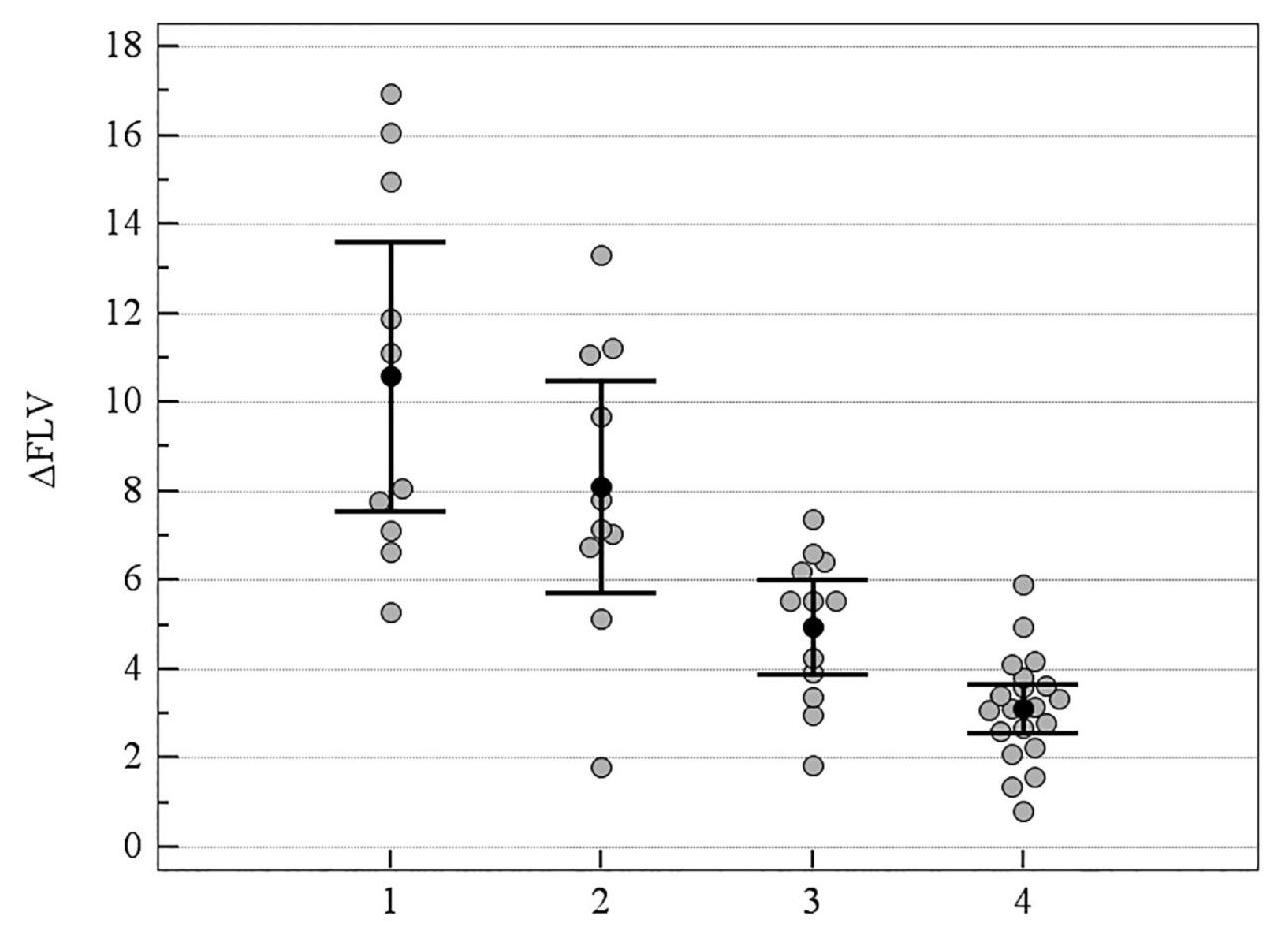
Рисунок 8. Медианное значение (95 % ДИ) изменения показателя FLV у пациентов с ІІІ стадией ПОУГ: 1 – традиционное лечение; 2 – мемантин; 3 – цитиколин; 4 – цитиколин и мемантин
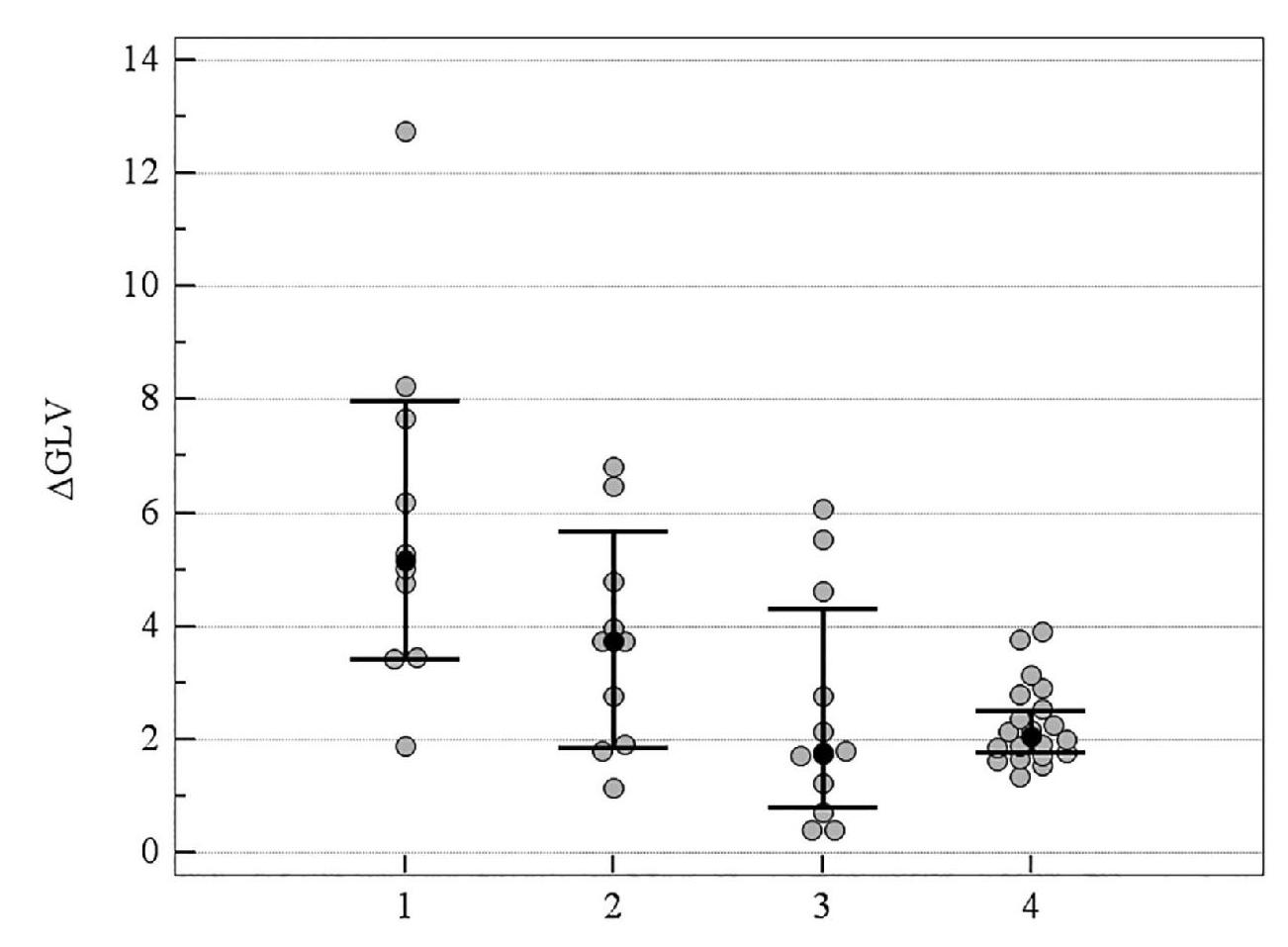
Рисунок 9. Медианное значение (95 % ДИ) изменения показателя GLV у пациентов с ІІІ стадией ПОУГ: 1 – традиционное лечение; 2 – мемантин; 3 – цитиколин; 4 – цитиколин и мемантин
Отличия изменений функциональных показателей периметрии, которые отражают прогрессирующую гибель ганглиозных клеток сетчатки за период наблюдения как во ІІ, так и в ІІІ стадии ПОУГ между группами, которые получали разные виды лечения, были выражены в меньшей степени. У пациентов с ПОУГ ІІ стадии, получавших комбинацию нейропротекторных препаратов прямого действия, изменение показателя MD достоверно отличалось от изменения этого показателя у больных, которые получали традиционное консервативное лечение: ΔMD 0,54 (95 % ДИ 0,43; 0,97) и 1,02 (95% ДИ –0,68; 1,70), р = 0,04. Степень изменения PSD отражала тенденцию: ΔPSD 0,55 (95 % ДИ –0,08; 1,18) и 0,97 (95 % ДИ 0,59; 1,35), р = 0,4 (см. таблицу 3). У пациентов с ПОУГ ІІІ стадии, которые получали комбинацию нейропротекторных препаратов прямого действия, в меньшей степени отличались изменения показателя MD от группы больных с традиционным лечением: ΔMD 2,62 (95 % ДИ 1,56; 3,68) и 4,65 (95 % ДИ 2,33; 6,97), р = 0,09. Изменение показателя PSD было статистически значимым: ΔPSD –0,17 (95 % ДИ –0,902; 0,56) и –2,19 (95 % ДИ –3,18; –1,21), р = 0,04 (см. таблицу 4).
На рисунках 6–9 представлено медианное значение (95 % ДИ) изменения объективных морфологических показателей RNFL, GCC, FLV, GLV за 8-летний период в группах пациентов с ІІІ стадией ПОУГ, которые получали разную нейротропную терапию. При долгосрочном наблюдении не была выявлена зависимость уменьшения объемного показателя Vrim от вида лечения, что можно объяснить терминальными морфологическими повреждениями ганглиозных клеток сетчатки в далекозашедшей стадии глаукомы. Но изменения всех остальных морфологических показателей – RNFL, GCC, FLV, GLV – было статистически значимо выражено в меньшей степени в группах комбинированного лечения и монотерапии с цитиколином по сравнению с традиционным лечением. Отрицательная динамика показателей RNFL и GCC также выражена в большей степени в группе монотерапии с мемантином в сравнении с группами комбинированного лечения и монотерапии с цитиколином (p < 0,05). Кроме этого, значимо отличались изменения показателя FLV, который отражает локальные повреждения ГКС, в группе монотерапии с мемантином в сравнении с группами комбинированного лечения (см. таблицу 4, рисунки 6–9).
Таким образом, при долгосрочном наблюдении (2011–2019 гг.) наиболее высокая эффективность прямой нейропротекции при ІІІ стадии ПОУГ выявлена при комбинированной терапии цитиколина и мемантина.
Результаты нейропротекторной монотерапии с мемантином, также как и при ІІ стадии ПОУГ, у больных с ІІІ стадией ПОУГ практически не отличались от традиционного лечения.
Подобно изменениям морфологических показателей, изменились объективные электрофизиологические показатели, которые косвенно характеризуют ГОН – латентность ранних компонентов ЗВП. При ІІ cтадии ПОУГ у пациентов, которые получали комбинацию нейропротекторных препаратов прямого действия, изменение латентности (Δt) потенциалов N0 и N1 за 8 лет выражено в 2 раза меньше, по сравнению с больными, которые получали традиционное медикаментозное лечение. На фоне приема цитиколина и мемантина Δt N0 = 2,0 (95 % ДИ 2,0; 2,0) в сравнении с Δt N0 = 4,0 (95 % ДИ 3,6; 4,4) при традиционном лечении (р < 0,001). И соответственно Δt N1 = 4,0 (95 % ДИ 4,0; 6,0) при комбинированной нейропротекторной терапии в сравнении с Δt N1 = 8,0 (95 % ДИ 7,6; 14,4) при традиционной терапии (р < 0,001) (таблица 5).
Таблица 5. Изменение ранних компонентов ЗВП за период с 2011 по 2019 год у пациентов с ПОУГ ІІ стадии
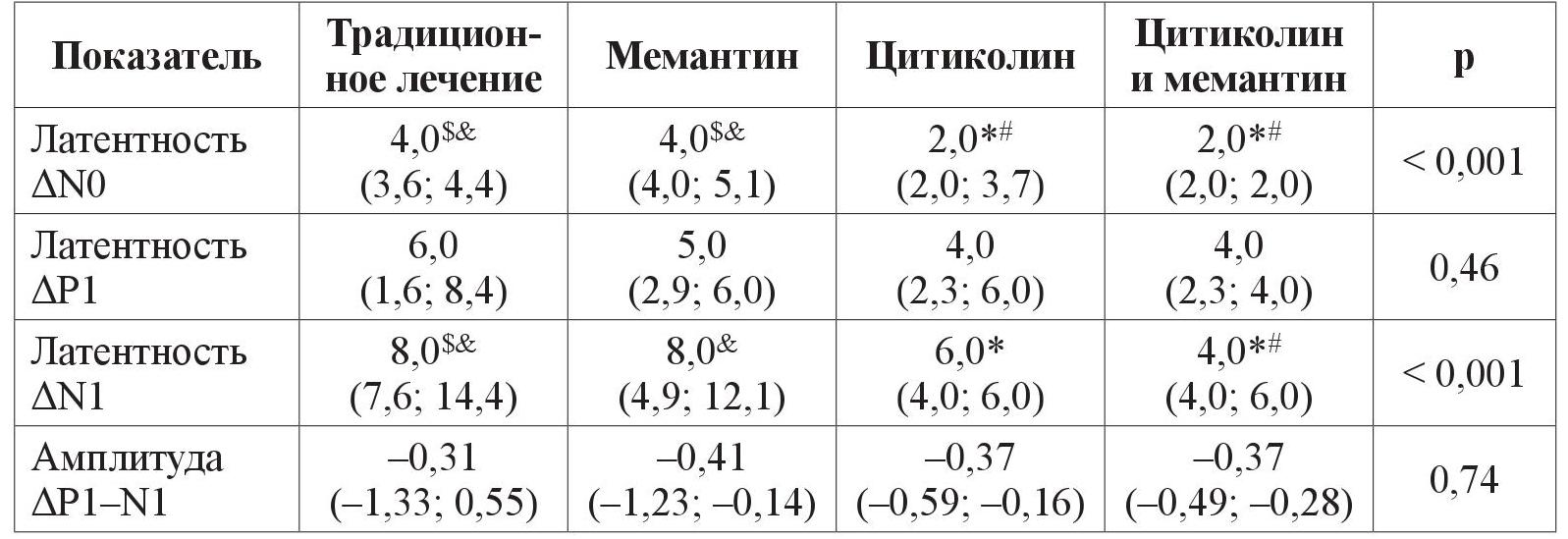
Примечание. р – уровень значимоcти отличия. Результаты представлены как (95 % ДИ) в случае нормального закона распределения либо Ме (95 % ДИ) в случае закона распределения, отличного от нормального.
* – отличие от изменения показателей группы традиционного лечения статистически значимо, p < 0,05;
# – отличие от изменения показателей группы мемантина статистически значимо, p < 0,05;
$ – отличие от изменения показателей группы цитиколина статистически значимо, p < 0,05;
& – отличие от изменения показателей группы цитиколина и мемантина статистически значимо, p < 0,05.
На рисунках 10, 11 продемонстрировано медианное значение (95 % ДИ) изменения электрофизиологических показателей за 8-летний период в группах пациентов со ІІ стадией ПОУГ, которые получали разную нейротропную терапию. Увеличение латентности ЗВП отражает ухудшение проводимости импульса по афферентным путям зрительного анализатора. Изменение показателей латентности ранних пиков N0 и N1 статистически значимо отличалось в группе комбинированного лечения и группе монотерапии с цитиколином по сравнению с группой традиционного лечения. Кроме этого, изменение показателя N0 не отличалось у пациентов, которые принимали мемантин, от результатов группы, которая получала традиционное лечение. Увеличение латентности выражено в большей степени именно в группе традиционного лечения и группе монотерапии с мемантином (см. таблицу 5, рисунки 10–11).
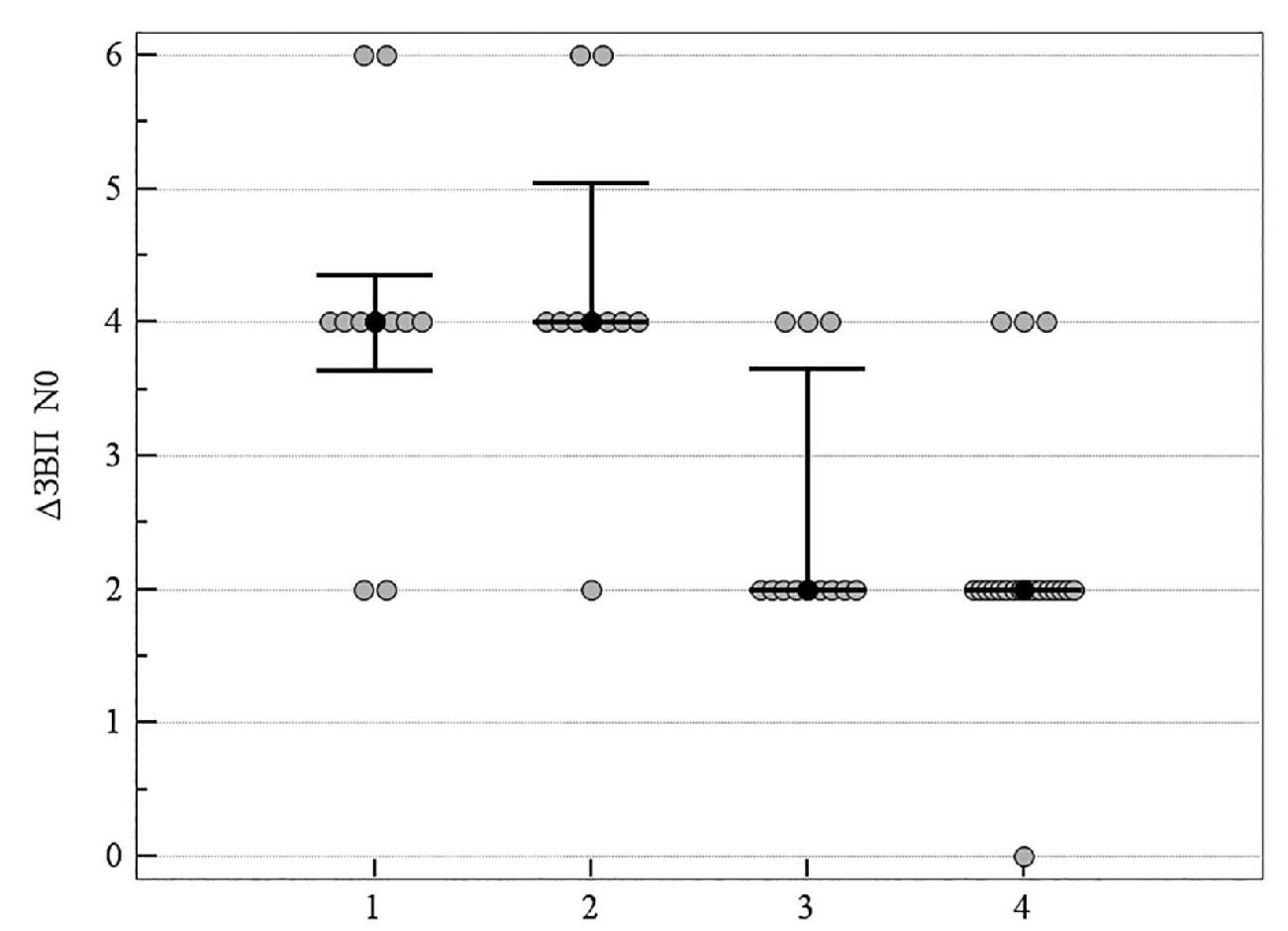
Рисунок 10. Медианное значение (95 % ДИ) изменения латентности ЗВП N0 у пациентов со ІІ стадией ПОУГ: 1 – традиционное лечение; 2 – мемантин; 3 – цитиколин; 4 – цитиколин и мемантин
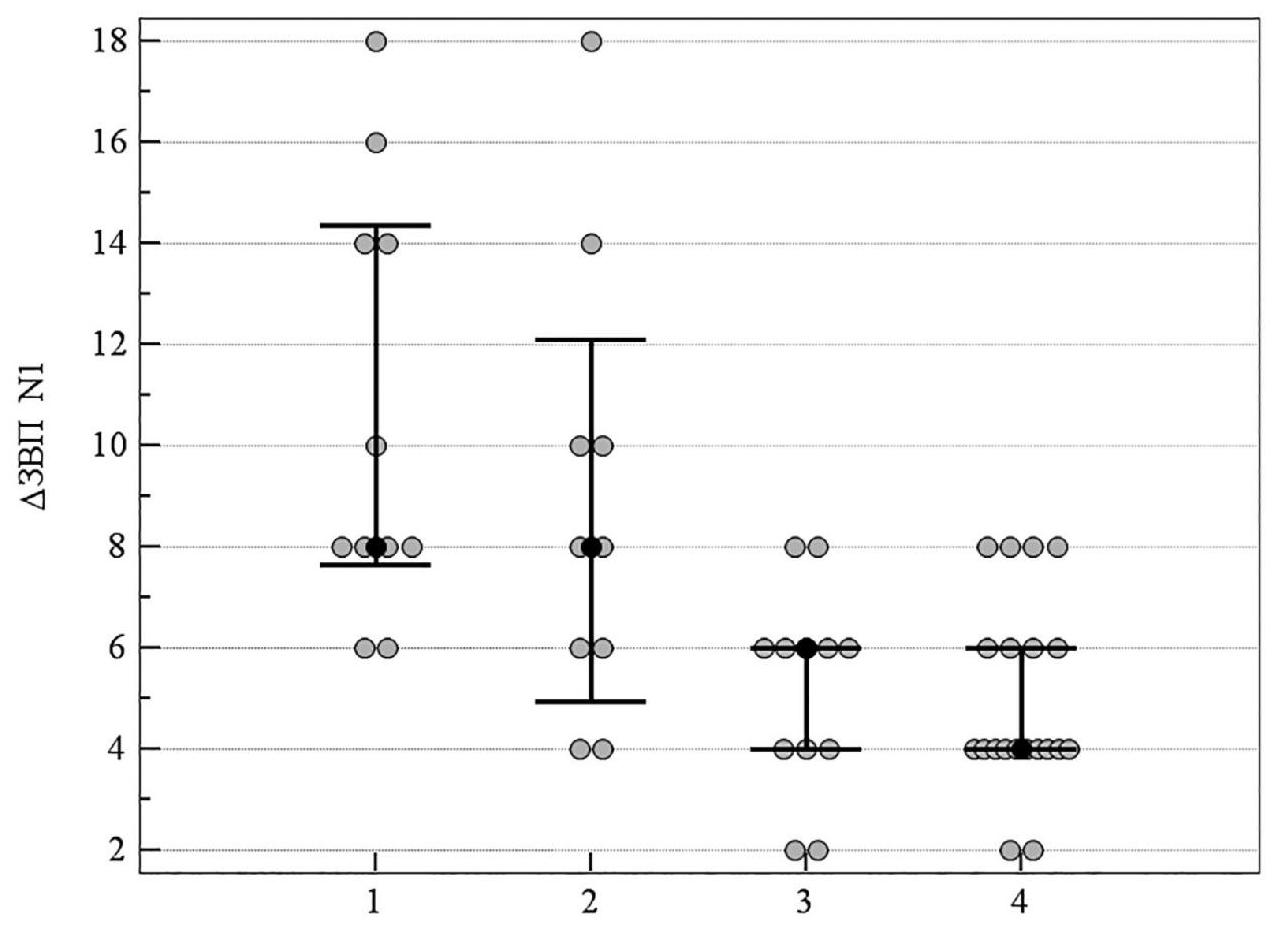
Рисунок 11. Медианное значение (95 % ДИ) изменения латентности показателя ЗВП N1 у пациентов со ІІ стадией ПОУГ: 1 – традиционное лечение; 2 – мемантин; 3 – цитиколин; 4 – цитиколин и мемантин
При ІІІ cтадии ПОУГ более значимыми были изменения показателей латентности ранних пиков Р1 и N1, которые достоверно отличались в группе комбинированного лечения и группе монотерапии с цитиколином по сравнению с группой традиционного лечения. У пациентов, которые получали комбинацию нейропротекторных препаратов прямого действия, Δt Р1 = 6,0 (95 % ДИ 4,0; 6,0) в сравнении с Δt Р1 = 8,0 (95 % ДИ 6,0; 10,1) у больных, которые получали традиционное консервативное лечение (р = 0,001), а также Δt N1 = 4,0 (95 % ДИ 4,0; 6,0) в сравнении с Δt N1 = 9,0 (95 % ДИ 8,0; 17,05) соответственно (р < 0,001). В то же время, степень изменения показателей Р1 и N1 достоверно не отличалась в группах пациентов, которые получали монотерпию с мемантином и традиционное лечение (таблица 6, рисунки 12, 13).
Таблица 6. Изменение ранних компонентов ЗВП за период с 2011 по 2019 год у пациентов с ПОУГ ІІІ стадии
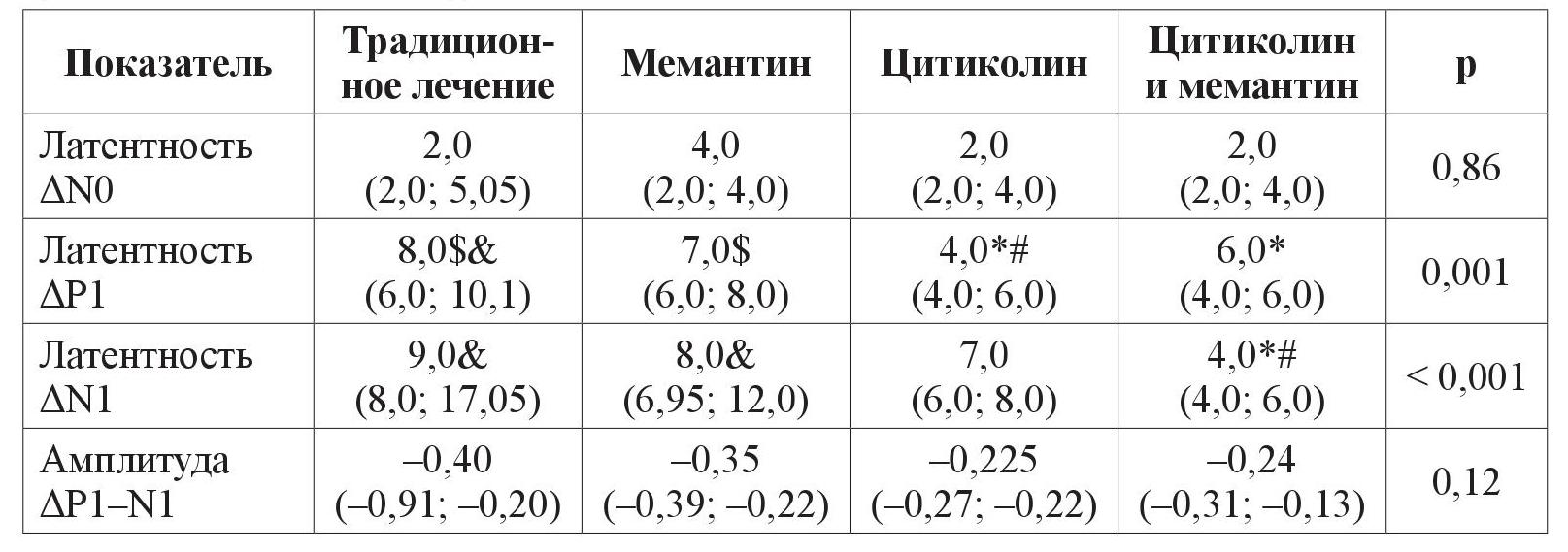
Примечание. р – уровень значимоcти отличия. Результаты представлены как (95 % ДИ) в случае нормального закона распределения либо Ме (95 % ДИ) в случае закона распределения, отличного от нормального.
* – отличие от изменения показателей группы традиционного лечения статистически значимо, p < 0,05;
# – отличие от изменения показателей группы мемантина статистически значимо, p < 0,05;
$ – отличие от изменения показателей группы цитиколина статистически значимо, p < 0,05;
& – отличие от изменения показателей группы цитиколина и мемантина статистически значимо, p < 0,05.
За 8-летний период наблюдения результаты нейропротекторной монотерапии с мемантином независимо от стадии ПОУГ по данным как морфологических, так и электрофизиологических показателей не отличались от традиционного лечения, что согласуется с выводами проспективного рандомизированного двойного слепого исследования эффективности мемантина, в которое были вовлечены более 2000 пациентов с глаукомой на фоне компенсации ВГД. По результатам указанного исследования была выявлена лишь тенденция к замедлению прогрессирования периметрических изменений [15, 16].
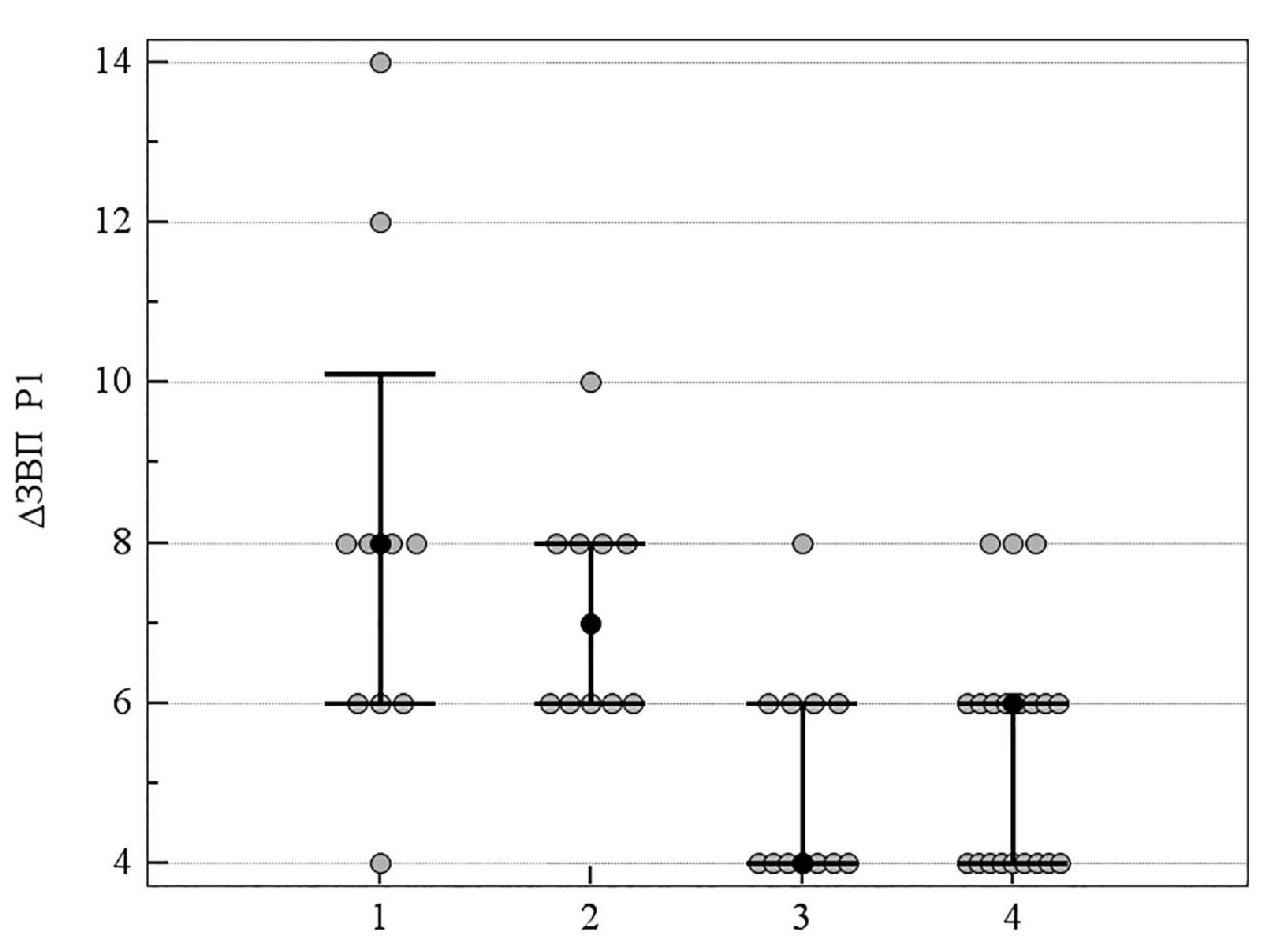
Рисунок 12. Медианное значение (95 % ДИ) изменения латентности ЗВП Р1 у пациентов с ІІІ стадией ПОУГ: 1 – традиционное лечение; 2 – мемантин; 3 – цитиколин; 4 – цитиколин и мемантин
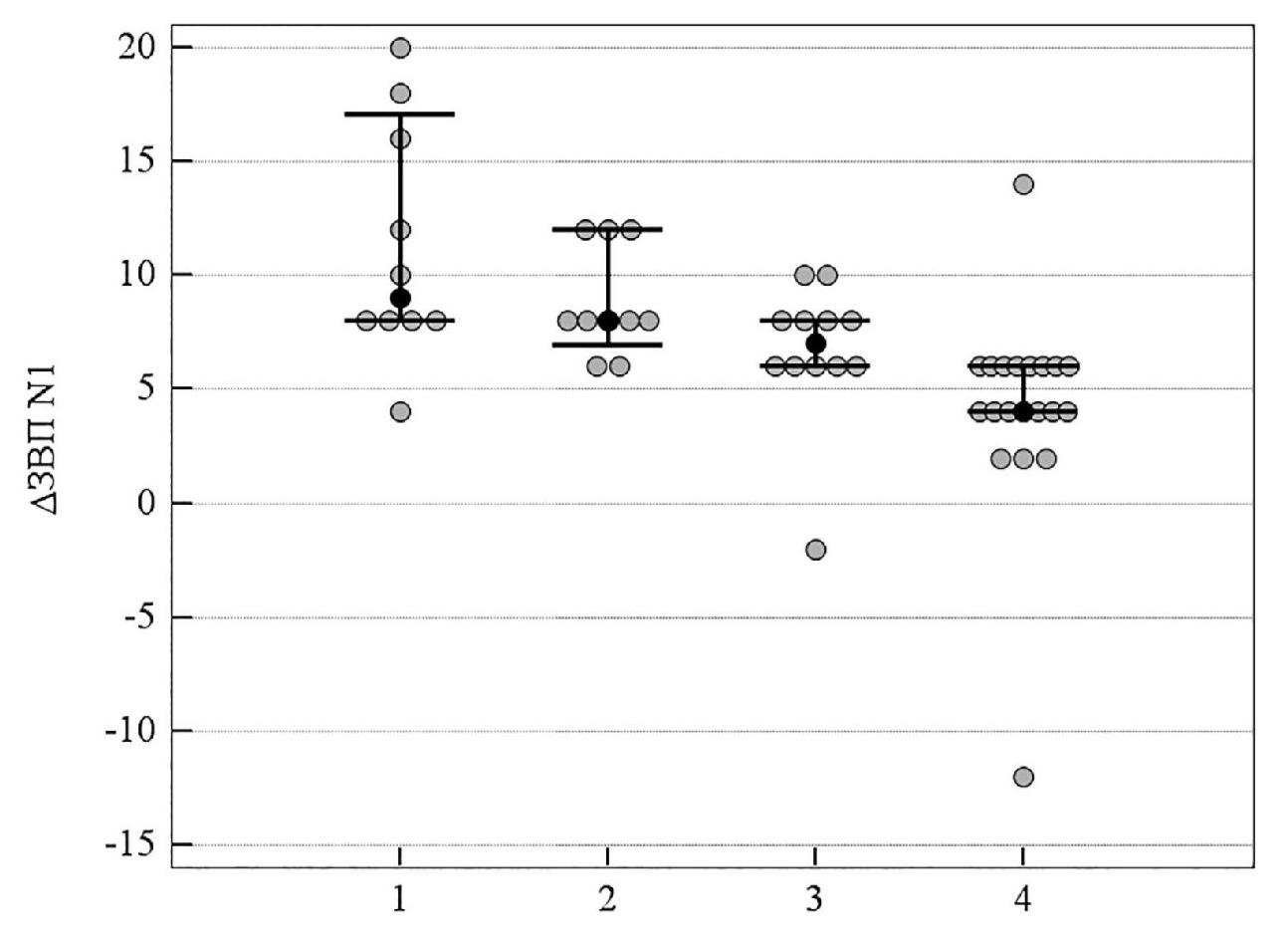
Рисунок 13. Медианное значение (95 % ДИ) изменения латентности ЗВП N1 у пациентов с ІІІ стадией ПОУГ: 1 – традиционное лечение; 2 – мемантин; 3 – цитиколин; 4 – цитиколин и мемантин
Долгосрочное наблюдение за период 2011–2019 гг. продемонстрировало менее выраженную степень ухудшения морфологических и электрофизиологических показателей в группах пациентов, которые получали комбинацию нейропротекторных препаратов прямого действия цитиколина и мемантина, в среднем в 2–2,5 раза по сравнению с группой традиционного лечения (см. таблицы 3–6).
Выводы
1. Применение прямой нейропротекторной терапии позволяет замедлить прогрессирование ГОН. По данным морфологических (RNFL, GCC, GLV, FLV) и электрофизиологических (латентность ранних компонентов ЗВП) показателей у пациентов с ПОУГ, которые получали комбинацию нейропротекторных препаратов прямого действия, интенсивность прогрессирования ГОН за период с 2011 по 2019 год достоверно ниже, чем у больных, получавших традиционное консервативное лечение (р ≤ 0,001).
2. Наиболее высокая эффективность прямой нейропротекции выявлена для ІІ стадии ПОУГ при монотерапии с цитиколином, а для ІІІ стадии ПОУГ при комбинированной терапии цитиколина и мемантина.
3. При долгосрочном наблюдении (2011–2019 гг.) результаты нейропротекторной монотерапии с мемантином не отличались от традиционного лечения.
4. За период наблюдения с 2011 по 2019 год у пациентов, которые получали комбинированную нейропротекторную терапию цитиколином и мемантином отмечалось замедление прогрессирования ГОН по всем объективным показателям в 2–2,5 раза по сравнению с группой традиционного лечения.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
REFERENCES
- Joo CK, Choi JS, Ko HW. Necrosis and apoptosis after retinal ischemia: involvement of NMDA-mediated excitotoxicity and p53. Invest. Ophthalmol. Vis. Sci. 1999;40:713–20.
- MacInnis B, Campenot R. Regulation of Wallerian degeneration and nerve growth factor withdrawal-induced pruning of axons of sympathetic neurons by the proteasome and the MEK/ Erk pathway. Mol. Cell. Neurosci. 2005;28:430–9.
- Сердюк ВН, Семенко ВВ. Влияние светового облучения на состояние процессов перекисного окисления липидов в тканях глаза при моделировании первичной глаукомы. Офтальмол. журн. 2011;1:65–9. Serdiuk VN, Semenko VV. [Influence of the light irradiation in the state of the lipid peroxidation processes in the eye tissues in modeling primary glaucoma]. J.ophthalmol. 2011;1:65–9. Ukrainian.
- Сердюк ВН. Исследование цикла нейротоксического трансмиттера – глутамата в сетчатке при экспериментальной глаукоме. Офтальмол. журн. 2012;2:58–63. Serdiuk V. [Study of the Cycle of Neurotoxic Transmitter – Glutamate in the Retina in Experimental Glaucoma]. J.ophthalmol. 2012;2:58–63. Ukrainian.
- Carter-Dawson L, Crawford ML, Harwerth RS, et al. Vitreal glutamate concentration in monkeys with experimental glaucoma. Invest. Ophthalmol. Vis. Sci. 2002;43:2633–7.
- Guo L, Salt TE, Maass A, et al. Assessment of neuroprotective effects of glutamate modulation on glaucoma-related retinal ganglion cell apoptosis in vivo. Invest. Ophthalmol. Vis. Sci. 2006; 47:626–33.
- Harada T, Harada C, Nakamura K, et al. The potential role of glutamate transporters in the pathogenesis of normal-tension glaucoma. J. Clin. Invest. 2007;117(7):1763–70.
- Abu-Amero KK, Morales J, Bosley TM. Mitochondrial abnormalities in patients with primary open-angle glaucoma. Invest. Ophthalmol. Vis. Sci. 2006;47:2533–41.
- Secades JJ. Citicoline: pharmacological and clinical review, 2010 update. Rev. Neurol. 2011;52 (Suppl 2):S1–S62.
- Sobrado M, López MG, Carceller F, et al. Combined nimodipine and citicoline reduce infarct size, attenuate apoptosis and increase bcl-2 expression after focal cerebral ischemia. Neuroscience. 2003;118(1):107–13.
- European Glaucoma Society Terminology and Guidelines for Glaucoma, 4th Edition - Chapter 1. British Journal of Ophthalmology. 2017;101:1–72.
- Гнездицкий ВВ, Корепина ОС. Атлас по вызванным потенциалам (практическое руководство, основанное на анализе конкретных клинических наблюдений). Иваново: ПресСтож; 2011. Gnezdeckiy VV, Korepina OS. [Atlas on evoked potentials (practical guide based on analysis of specifc wedges scientifc observations)]. Ivanovo;2011.
- Шамшинова АМ, Волков ВВ. Функциональные методы исследования в офтальмологии. Москва: Медицина; 1999. Shamshinova AM, Volkov VV. [Functional research methods in ophthalmology]. Moscow; 1999.
- Odom JV, Bach M, Brigell M, et al. ISCEV standard for clinical visual evoked potentials (2009 update). Doc. Ophthalmol. 2010;120(1):111–9.
- European Glaucoma Society Terminology and Guidelines for Glaucoma, 4th Edition - Chapter 3: Treatment principles and options. British Journal of Ophthalmology. 2017;101: 130–95.
- Osborne NN. Recent clinical findings with memantine should not mean that the idea of neuroprotection in glaucoma is abandoned. Acta Ophthalmol. 2009;87(4):450–4.
Стаття надійшла в редакцію 25.09.2019 р.
Рецензія на статтю надійшла в редакцію 21.10.2019 р.