- Автор: Super User
- Категорія: Український журнал «Офтальмологія» № 1 (11) 2020
- Опубліковано: 16 листопада 2020
- Перегляди: 3003
УДК 617.7-089.5-03:615.212
https://doi.org/10.30702/Ophthalmology30092020-11.1.1506-13
Сердюк В. М.2, д-р мед. наук, професор кафедри офтальмології та неврології
Минка Н. В.1, 2, лікар-анестезіолог, аспірант кафедри анестезіології та інтенсивної терапії
Кобеляцький Ю. Ю.2, д-р мед. наук, професор, завідувач кафедри анестезіології та інтенсивної терапії
1КП «Дніпропетровська обласна клінічна офтальмологічна лікарня», м. Дніпро, Україна
2ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Резюме. У статті наведено порівняльний аналіз двох схем знеболювання під час оперативного втручання з приводу трансплантації рогівки: багатокомпонентна збалансована анестезія (внутрішньовенна + інгаляційна) та багатокомпонентна збалансована анестезія, доповнена блокадою крило-піднебінної ямки. Автори дослідили вплив цих двох схем анестезіологічного забезпечення на динаміку больового сприйняття та частоту виникнення післяопераційної нудоти й блювання у післяопераційному періоді.
Ключові слова: післяопераційний біль, оцінювання болю, схеми знеболювання, офтальмохірургія.
Serdiuk V.2, Mynka N.1, 2, Kobelyatsky Yu.2
1Dnipropetrovsk Regional Ophthalmological Clinical Hospital, Dnipro, Ukraine
2Dnipropetrovsk Medical Academy of the Ministry of Health of Ukraine, Dnipro, Ukraine
Pterygopalatine Fossa Block as a Component of Multimodal Anesthesia in an Ophthalmic Surgery
Abstract
Materials and methods. The study included 20 patients aged 25 to 84, 11 men and 9 women with various front eye pathologies. 10 patients were anesthetized according to the classic scheme taken in our clinic. In the other 10 patients, the pain relief scheme was supplemented by the implementation of pterygopalatine fossa block. Monitoring during the operation included non-invasive monitoring of hemodynamics, pulsoxymetry, determination of oxygen and carbon dioxide concentration in exhaled air. In postoperative period level of pain was fixed using visual-analogue scale and frequency of postoperative nausea and vomiting.
Results. The study found that patients in the groups had no statistically significant differences in sex, age and severity of surgery. At all stages of the study, the severity of pain in patients with the pterygopalatine fossa block was reliably lower than in patients in the control group. The incidence of postoperative nausea and vomiting was also lower in the blockade group.
Keywords: postoperative pain, assessment of pain, scheme of anesthesia, ophthalmic surgery.
Вступ
Важливим аспектом сучасної анестезіології є недостатній контроль болю після хірургічного втручання. Значна кількість пацієнтів (80–90 %) після перенесеної операції скаржиться на біль від помірного до найсильнішого впродовж перших двох тижнів [1, 2].
Встановлено, що недостатнє знеболювання в післяопераційному періоді не тільки негативно впливає на психологічний стан пацієнтів, а й призводить до фізіологічних наслідків, таких як зміни з боку серцево-судинної та дихальної систем, обмеження рухливості, імуносупресія, порушення сну, поганий апетит, медикаментозна залежність, високий ризик хронізації болю. Гіперкатехоламінемія, що виникає внаслідок збудження гіпоталамо-гіпофізарно-кортико-адреналової системи, зумовлює розвиток тахікардії, гіпертензії, аритмії і може закінчитися гострою ішемією міокарда. Знижується життєва ємність легень з ателектазуванням, виникає пневмонія. Спазм судин у зоні спланхнікуса призводить до парезу кишківника і транслокації кишкової флори. Вплив на згортання крові супроводжується гіперкоагуляцією з наступним розвитком тромбозу глибоких вен, тромбоемболією легеневої артерії. Вплив післяопераційного болю на центральну нервову систему спричинює формування хронічного больового синдрому [4].
При цьому, незважаючи на зростаючий інтерес до проблеми післяопераційного знеболювання, а також досягнення фундаментальних наук у вивченні механізмів болю, якість знеболювання залишається незадовільною [3]. Малоінвазивна хірургія, до якої можна віднести й офтальмохірургію, не стала виключенням з глобальної тенденції. Хворі, що перенесли «малі» оперативні втручання, досить часто скаржаться на виражений післяопераційний біль і недостатню якість знеболювання. Тому питання контролю болю в малоінвазивній хірургії залишається актуальним і потребує подальшого вивчення.
Матеріали та методи
У дослідження було включено 20 пацієнтів з патологією переднього відрізка ока, серед них 11 чоловіків і 9 жінок віком від 25 до 84 років, яким було виконане оперативне втручання кератопластику впродовж 7 місяців 2018 року на базі КЗ «Дніпропетровська обласна клінічна офтальмологічна лікарня». За шкалою ASA пацієнти були віднесені до 1–2 класів. Усіх пацієнтів обстежили згідно з протоколом передопераційної підготовки.
Пацієнти були рандомізовані на дві групи. До першої групи – групи К (n = 10) – увійшли пацієнти, яким анестезіологічне забезпечення було виконано за «класичною» схемою, прийнятою у нашій лікарні. Застосовували багатокомпонентну збалансовану анестезію за такою методикою: 1) премедикація – ондансетрон 4 мг, дексаметазон 4 мг, кеторолак 30 мг внутрішньовенно, сибазон 10 мг, фентаніл 0,1 мг внутрішньом’язово за 40 хвилин до втручання; 2) індукція пропофолом 2–2,5 мг/кг фракційно до досягнення клінічних симптомів наркозу, фентаніл 0,005 % 0,1 мг; 3) інтубація трахеї після релаксації на тлі атракурію безилату 0,3–0,6 мг/кг; 4) підтримка анестезії: киснево – севофлуранова суміш FiO2 50–55 %, севофлуран 1,4– 1,8 об.% на видиху (1–1,5 МАС) при потоці не більше ніж 1 л/хв. Показники BIS підтримували на рівні 30–40, впродовж оперативного втручання використовували болюсне введення фентанілу по 0,1 мг внутрішньовенно в разі появи гемодинамічних реакцій.
У другій групі – групі Б (n = 10) – вищеописану схему анестезіологічного забезпечення доповнили виконанням блокади крило-піднебінної ямки.
Інтраопераційний моніторинг пацієнтів в обох групах включав: неінвазивне вимірювання артеріального тиску (АТ), частоти серцевих скорочень (ЧСС), пульсоксиметрію, визначення концентрації кисню, вуглекислого газу та інгаляційного анестетика на вдиху і видиху, реєстрацію біспектрального індексу в режимі on-line. Усім пацієнтам виконано катетеризацію периферичної вени, темп інтраопераційної інфузії не перевищував 3–5 мл/кг/год. Рівень післяопераційного болю визначали за візуально-аналоговою шкалою (ВАШ).
Оцінювання болю за ВАШ проводили вперше на операційному столі (одразу після екстубації трахеї), далі – через 2, 6 годин та на наступний ранок після перенесеного оперативного втручання.
Інтерпретація даних за ВАШ:
– 0 – нема болю;
– 1–3 бали – слабкий біль;
– 4–5 балів – помірний біль;
– 6–9 балів – сильний біль;
– 10 балів – найсильніший біль, якій тільки можна уявити.
Інтерпретація результатів знеболювання:
– немає болю – 0 балів;
– адекватне знеболювання – 1–4 бали;
– необхідно додаткове знеболювання (помірний біль) – 5 балів;
– необхідно додаткове знеболювання наркотичними анальгетиками (сильний біль) – 6–10 балів.
Для вирішення завдань дослідження було використано пакет прикладних програм Microsoft Word, Microsoft Excel та Statistica 10. Для статистичного оцінювання кількісних показників у групах дослідження було застосовано T-критерій Стьюдента в разі нормального розподілу показників і U-критерій Манна – Уітні для показників, що мають розподіл, відмінний від нормального. Різницю між порівнюваними показниками вважали достовірною при p < 0,05.
Результати та обговорення Пацієнти в обох групах статистично не відрізнялися між собою за віком, статтю та анестезіологічним ризиком (таблиця 1). Обсяг оперативного втручання також не відрізнявся між групами дослідження.
Таблиця 1. Характеристика пацієнтів у групах дослідження
Responsive Table
| Показник | Група К | Група Б |
|---|---|---|
| Вік, роки | 53,3 ± 5,76 | 43,5 ± 6,31 |
| Стать (чоловіча/жіноча) | 6/4 | 5/5 |
| Клас за ASA | I–II | I–II |
Показники, що характеризують гемодинаміку і газообмін фіксували на чотирьох етапах дослідження (початок операції, етап «відкритого неба», кінець операції, через 6 годин після втручання). Отримані показники наведені в таблиці 2.
Таблиця 2. Показники гемодинаміки та газообміну в групах дослідження
| Показник/ етап | Початок операції | Етап «відкритого неба» | Кінець операції | Через 6 годин після втручанн | ||||
| Група К | Група Б | Група К | Група Б | Група К | Група Б | Група К | Група Б | |
| Середній АТ | 93 (84; 113) | 95,5 (85; 107) | 94 (67; 117) | 84 (64; 99) | 66 (57; 81) | 73 (56; 82) | 98 (78; 113) | 83 (75; 113) |
| ЧСС | 76 (55; 80) | 80 (64; 109) | 70 (50; 89) | 72 (57; 116) | 69 (52; 84) | 66 (57; 84) | 77 (63; 84) | 76 (65; 112) |
| SpO2 | 99 (97; 100) | 99 (95; 100) | 99 (96; 100) | 99 (95; 100) | 99 (97; 100) | 99 (97; 100) | – | – |
| EtCO2 | 32 (22; 37) | 26 (20; 30) | 33 (21; 38) | 27 (21; 35) | 39 (30; 42) | 30 (20; 36) | – | – |
Наведені дані свідчать, що показники гемодинаміки в обох групах суттєво не відрізнялися між собою впродовж операції. Показники адекватності оксигенації та вентиляції (SpO2 і EtCO2) в обох групах відповідали нормальним значенням і не відрізнялися від рівня стрес-норми.
Дані, наведені у таблиці 2, свідчать про відсутність суттєвої різниці у показниках гемодинаміки та газообміну між двома групами.
Відновлення спонтанного дихання та видалення ларингеальної маски з дихальних шляхів відбувалось на операційному столі. Тоді ж проводили першу реєстрацію рівня болю за ВАШ. Рівень болю на цьому етапі в обох групах був мінімальним – 0–2 бали. Однак у групі Б кількість хворих, які зовсім не відчували болю (ВАШ = 0), була значно вищою, ніж у групі К.
Динаміку показників рівня післяопераційного болю за ВАШ у першу добу після операції наведено в таблиці 3.
Таблиця 3. Рівень післяопераційного болю в групах дослідження
| Показник, бали | Час після операції, годин | |||
| Екстубація | 2 | 6 | Ранок | |
| Рівень болю, група К | 2 (0; 2) | 4 (2; 8) | 6,5 (2; 8) | 3,5 (1; 5) |
| Рівень болю, група Б | 0 (0; 2) | 1 (0; 4) | 1 (0; 5) | 1 (0; 4) |
| p | p = 0,02 | p = 0,001 | p = 0,001 | p = 0,01 |
Як видно з таблиці 3 та рисунка 1, рівень болю через 2 години після втручання у групі К (n = 10) відповідав болю середньої інтенсивності за ВАШ (4 (2; 8) – Me (25 %; 75 %)), тоді як у групі Б (n = 10), він був значно нижчим, і відповідав слабкому болю за ВАШ (1 (0; 4) – Me (25 %; 75 %)) (р = 0,001 за критерієм Манна – Уітні).
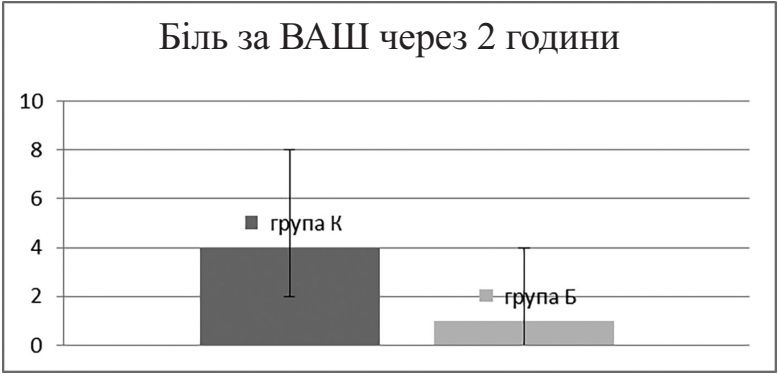
Рисунок 1. Рівень болю через 2 години після оперативного втручання
Подібна закономірність зберігалася протягом усього часу спостереження. Так, через 6 годин біль у пацієнтів групи К (n = 10) відповідав сильному болю (6,5 (2; 8) – Me (25 %; 75 %)), що потребувало додаткового знеболювання (внутрішньовенного введення кеторолаку), тоді як у групі Б (n = 10) інтенсивність болю залишалася на низькому рівні і додаткового знеболювання не застосовували (р = 0,001 за критерієм Манна – Уітні). Дані через 6 годин наведені на рисунку 2.
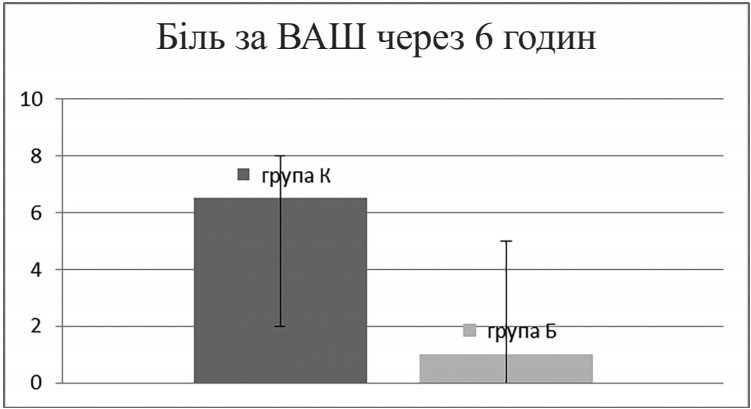
Рисунок 2. Рівень болю через 6 годин після оперативного втручання
На ранок після оперативного втручання (рисунок 3) у пацієнтів групи К (n = 10) рівень болю відповідав середній інтенсивності (3,5 (1; 5) – Me (25 %; 75 %)), а в групі Б (n = 10) так і залишався слабким (1 (0; 4) – Me (25 %; 75 %)), (р = 0,01 за критерієм Манна – Уітні).
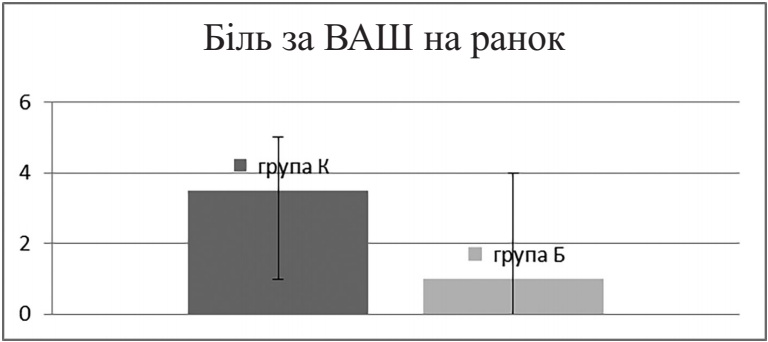
Рисунок 3. Рівень болю на ранок після операції
Як видно з рисунка 4, кількість випадків виникнення у пацієнтів післяопераційної нудоти та блювання (ПОНБ) також була більшою у групі К (n = 10) у 6 пацієнтів, що становило 60 % (60 ± 15,49), тоді як у групі Б (n = 10) у 2 пацієнтів – 20 % (20 ± 12,65).
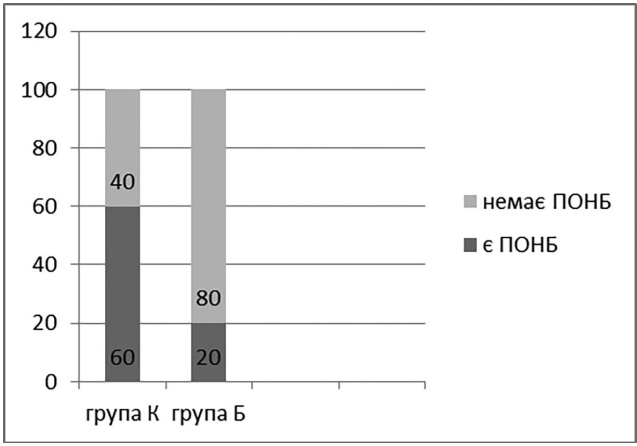
Рисунок 4. Кількість виникнення ПОНБ у пацієнтів після операції
Висновки
1. Блокада крило-піднебінної ямки є ефективним і безпечним анальгетичним компонентом у складі мультимодальної інтраопераційної анальгезії при оперативних втручаннях у пацієнтів офтальмохірургічного профілю.
2. Виконання блокади крило-піднебінної ямки до початку оперативного втручання забезпечує високий рівень післяопераційного комфорту у пацієнтів, а також сприяє зниженню кількості випадків виникнення у післяопераційному періоді нудоти та блювання, що дуже важливо для збереження гарних результатів після офтальмохірургічних втручань.
3. Питання розробки альтернативних схем інтраопераційної анальгезії в офтальмохірургії є актуальним і перспективним напрямом.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці цієї статті.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
REFERENCES
- Oderda G. Challenges in the Management of Acute Postsurgical Pain. Pharmacotherapy. 2012 Sep;32(9 Suppl pt 2):6S-11S. https://doi.org/10.1002/j.1875-9114.2012.01177.x
- Gerbershagen HJ, Aduckathil S, van Wijck AJ, Peelen LM, Kalkman CJ, Meissner W. Pain Intensity on the First Day after Surgery: A prospective cohort study comparing 179 surgical procedures. Anesthesiology. 2013 Apr;118(4):934-44. https://doi.org/10.1097/ALN.0b013e31828866b3
- Клигуненко ЕН, Лященко ОВ. Нестероидные противовоспалительные препараты в лечении послеоперационного болевого синдрома. Днепропетровск; 2010. Klyhunenko EN, Liashchenko OV. [Non-steroidal anti-inflammatory drugs in the treatment of postoperative pain syndrome]. Dnipropetrovsk; 2010. Russian.
- Черний ВИ, Куглер СЕ. Новые возможности послеоперационного обезболивания. Травма. 2016;17(2):29-35. Chernii VI, Kuhler SYe. [New Features of Postoperative Analgesia]. Trauma. 2016;17(2): 29-35. Russian.
Стаття надійшла в редакцію 23.06.2020 р.
Рецензія на статтю надійшла в редакцію 07.07.2020 р.