- Автор: Super User
- Категорія: Український журнал «Офтальмологія» № 1 (12) 2021
- Опубліковано: 05 квітня 2021
- Перегляди: 4980
https://doi.org/10.30702/Ophthalmology31032021-12.1.57-66/045
УДК 617.7-002:616.441-008.63]:616-07-085]-027.521](045)
Петренко О. В., д-р мед. наук, професор кафедри офтальмології
Прусак О. І., аспірант кафедри офтальмології
Національний університет охорони здоров’я України імені П. Л. Шупика, м. Київ, Україна
Резюме
Актуальність. У статті висвітлено основні підходи до лікування пацієнтів з ендокринною орбітопатією (ЕО) і сучасні можливості для планування та проведення індивідуалізованої декомпресії орбіти, зокрема використання ComputerAided Design (CAD) / Computer-Aided Manufacturing (CAM) технологій. Оптимізація лікування цієї патології, яка може призвести до зміни зовнішнього вигляду, неможливості виконувати звичну роботу, соціальної ізоляції, а в найскладніших випадках до втрати зору, є актуальною проблемою офтальмології та щелепно-лицевої хірургії.
Мета. Проаналізувати сучасні відомості щодо основних підходів до лікування пацієнтів з ендокринною орбітопатією і можливості використання комп’ютерних технологій для планування та проведення персоналізованої декомпресії орбіти.
Результати. Застосування кортикостероїдів, променева терапія, хірургічне лікування – основні методи, які використовують для ведення пацієнтів з ЕО. Використання CAD/CAM-технологій дає змогу спланувати оперативне втручання відповідно до морфологічних особливостей орбіти кожного пацієнта, що потенційно можуть впливати на результат декомпресії та зменшення екзофтальму, а також на появу інтраопераційних ускладнень. Саме через значну варіабельність морфологічних параметрів орбіт у разі застосування стандартних підходів результати в різних пацієнтів можуть значно відрізнятися, що диктує необхідність персоналізованого підходу до ведення пацієнтів з ЕО.
Висновки. EUGOGO-2016 рекомендує мультидисциплінарний поетапний підхід до ведення пацієнтів з ЕО, залежно від її активності і тяжкості та впливу на якість життя пацієнта. Персоналізований підхід до пацієнта з використанням комп’ютерного моделювання та розробка хірургічних навігаційних шаблонів для проведення хірургічної декомпресії орбіти забезпечать отримання оптимальних функціональних та естетичних результатів лікування.
Ключові слова: ендокринна орбітопатія, лікування, декомпресія орбіти, Computer-Aided Design (CAD) / Computer-Aided Manufacturing (CAM) технології, персоналізований підхід.
Ендокринна орбітопатія (ЕО) – це автоімунне захворювання, яке характеризується розширенням екстраокулярних м’язів і адипогенезом в орбіті й типово має дві фази: активну (запальну) і хронічну (фіброзну).
У 90 % випадків ЕО асоційована з хворобою Грейвса (орбітопатія Грейвса), але може спостерігатись у пацієнтів з автоімунним тиреоїдитом і з еутиреоїдним статусом. У 3–5 % випадків ЕО може призвести до дистироїдної оптичної нейропатії, яка включає прогресуючу втрату зору, погіршення кольорового зору, дефекти поля зору та набряк зорового диска, і, як наслідку, втрати зору [1, 2].
Хвороба Грейвса є найпоширенішою причиною гіпертиреозу в США, частота якого становить близько 1,2 % (0,5 % явного і 0,7 % субклінічного) [3].
Відзначено підвищення поширеності тиреоїдитів на 100 тис. населення в Україні за період 2007–2017 рр. у 2,5 раза (з 209,8 до 520,7 º/₀₀₀), гіпотиреозу – у 1,7 раза (з 170,4 до 282,3 º/₀₀₀), гіпертиреозу – у 1,5 раза (106,2 до 154,4 º/₀₀₀) [4]. Середній вік пацієнтів з ЕО – 46 ± 13,8 року, переважають жінки (75 %) [5].
Оскільки ЕО трапляється в молодих осіб працездатного віку і може призвести до зміни зовнішнього вигляду, неможливості виконувати звичну роботу, соціальної ізоляції, а в найскладніших випадках до втрати зору, то оптимізація сучасних методів лікування цієї патології із застосуванням персоналізованого підходу до пацієнта є актуальною проблемою офтальмології та щелепно-лицевої хірургії.
Патогенез орбітопатії Грейвса. Орбітальні фібробласти, які експресують високі рівні рецептора тиреотропного гормону (Thyroid stimulating hormone receptor (TSH-R)), стають центральною мішенню імунної реактивності [6, 7]. Дані нещодавно опублікованих досліджень показують, що стимулюючі антитіла до TSH-R зв’язуються з TSH-R, який у свою чергу взаємодіє з рецепторами інсуліноподібного фактора росту (insulin-like growth factor I receptor (IGF-IR)) на поверхні тироцитів, орбітальних фібробластів з утворенням фізичного та функціонального сигнального комплексу [6–8]. Таким чином активовані фібробласти генерують багато прозапальних і протизапальних факторів, зокрема цитокіни: інтерлейкін (IL)-1b, -6, -8, -10, -12 та -16; TNF-α; хемокін, ліганд CD40 (CD40L; CD154). Цитокіноактивовані фібробласти синтезують гіалуронат та інші глікозаміноглікани, які збільшують об’єм орбітальних тканин [6, 7].
Послідовно зміни окорухових м’язів та орбітальної жирової клітковини проходять стадії від набряку та інфільтрації до фіброзу і ремоделювання тканин, що клінічно проявляється проптозом (екзофтальмом) та обмеженням рухів очного яблука (рисунок 1) [9].
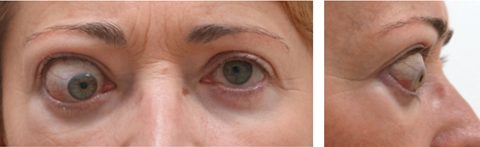
Рисунок 1. Зовнішній вигляд пацієнтки з ЕО
Згідно з рекомендаціями EUGOGO-2016, оптимальним є мультидисциплінарний підхід до лікування після ретельного оцінювання активності й тяжкості орбітопатії Грейвса та її впливу на якість життя пацієнта [2] із залученням мультидисциплінарної команди променевого діагноста, ендокринолога, офтальмолога й щелепно-лицевого хірурга.
Для визначення клінічної активності орбітопатії Грейвса користуються спеціальною модифікованою шкалою Сlinical activity score (CAS), запропонованою Mourits et al. [10]. Наявність у пацієнта трьох ознак із семи, CAS ≥ 3/7 свідчить про активний процес (таблиця 1).
Таблиця 1. Шкала клінічної активності орбітопатії Грейвса (Сlinical activity score (CAS))
| № | Ознака активності |
| 1 | Спонтанний ретробульбарний біль |
| 2 | Біль при спробі погляду вгору або вниз |
| 3 | Почервоніння повік |
| 4 | Почервоніння кон’юнктиви |
| 5 | Набряк сльозового м’ясця |
| 6 | Набряк повік |
| 7 | Набряк кон’юнктиви (хемоз) |
За ступенем тяжкості розрізняють легку, середньої тяжкості та дуже тяжку (із загрозою для зору) орбітопатію Грейвса згідно з рекомендаціями EUGOGO-2016 (таблиця 2), а також використовують шкалу NOSPECS [11].
Таблиця 2. Ступені тяжкості орбітопатії Грейвса
| Ступінь тяжкості | Критерії тяжкості |
| Легкий | Пацієнти з проявами орбітопатії Грейвса, які незначно впливають на повсякденне життя і недостатні для обґрунтування імуносупресивного або хірургічного лікування. Зазвичай наявне одне або більше з наступного: – незначна ретракція повіки (< 2 мм); – легке ураження м’яких тканин; – екзофтальм < 3 мм вище від норми для раси та статі; – відсутність або непостійна диплопія; – ураження рогівки, що реагують на лубриканти |
| Середньої тяжкості | Пацієнти, які не мають загрози зору, але захворювання очей справляє достатній вплив на повсякденне життя, щоб виправдати ризики імуносупресії (якщо орбітопатія Грейвса активна) або хірургічного втручання (якщо орбітопатія Грейвса неактивна). Зазвичай наявні два або більше з наступного: – ретракція повіки ≥ 2 мм; – помірне або сильне ураження м’яких тканин; – екзофтальм на ≥ 3 мм вище від норми для раси та статі; – непостійна або постійна диплопія |
| Дуже тяжкий | Пацієнти з дистиреоїдною оптичною нейропатією або ураженнями рогівки |
Призначення кортикостероїдів, променева терапія, хірургічне лікування – основні методи, які використовують для ведення хворих з ЕО послідовно або в певних комбінаціях для досягнення оптимальних результатів лікування і, як наслідок, покращення якості життя пацієнтів.
Для визначення якості життя пацієнтів з ЕО використовують спеціальну Анкету якості життя пацієнтів з орбітопатією Грейвса (GO-Quality Of Life Questionnaire (Terwee et al., 2001)), яка складається з двох частин: візуальне функціонування (8 запитань) і зовнішній вигляд (8 запитань). Пацієнт відзначає, наскільки він був обмежений у певних видах діяльності (водіння, переміщення по квартирі, прогулянки на свіжому повітрі, читання, перегляд телепередач та ін.), а також наскільки змінився його зовнішній вигляд, соціальні зв’язки, психологічний комфорт через захворювання щитоподібної залози впродовж минулого тижня.
Усі відповіді на запитання анкети оцінюються як «серйозно обмежено» – 1 бал, «дещо обмежено» – 2 бали, «зовсім не обмежено» – 3 бали. Запитання 1–8 (візуальне функціонування) і 9–16 (зовнішній вигляд) сумують до двох вихідних оцінок від 8 до 24 балів, а потім переводять у два загальних бали від 0 до 100 за такою формулою: загальний бал = ((вихідний бал – 8) / 16 × 100). Для обох загальних балів вищі показники вказують на кращу якість життя.
На запитання 1 і 2 можна виставити бали за відповіді «ніколи не вчився їздити» і «не маю водійських прав» як пропущені значення. Тоді загальний бал розраховується за формулою: загальний бал = ((вихідний бал – *) / (2 × *) × 100), де * – кількість виконаних елементів [12].
При тяжкому і середньому ступені тяжкості ОЕ застосовують хірургічне лікування, яке включає невідкладну декомпресію орбіти і реабілітаційну хірургію відповідно. Для збільшення об’єму кісткової орбіти розширюють медіальну, бічну стінки орбіти чи дно орбіти і/або видаляють певну кількість інфраорбітальної жирової клітковини (зазвичай з інфралатеральних та інфрамедіальних відділів), проте єдиний правильний підхід на сьогодні не визначено [2].
Реабілітаційна хірургія включає декомпресію орбіти (показання – виражений екзофтальм, ретроокулярний біль, кератопатія, що не піддається консервативній і променевій терапії), яку найкраще відкладати доти, поки орбітопатія не буде активною протягом принаймні 6 місяців.
У нещодавньому дослідженні Iacobaeus et al. продемонстровано позитивний вплив хірургічної декомпресії орбіти на якість життя пацієнтів [13].
Однак, за даними літератури, частота ускладнень хірургічної декомпресії орбіти становить від 9,3 до 35 %. Найчастіше у пацієнтів після класичних декомпресій орбіти спостерігають появу вторинної диплопії (10–35 %), рідко – ураження підочного нерва, витік спинномозкової рідини, епістаксис, кровотечі в орбіті та ін. [14, 15]. Оскільки хірурги використовують техніки, якими найкраще володіють, значна кількість інтраопераційних ускладнень можлива через клініко-анатомічні особливості орбіти.
Тому на сьогодні актуальним є пошук нових можливостей для планування і проведення хірургічних втручань, зокрема використання Computer-Aided Design (CAD) / Computer-Aided Manufacturing (CAM) технологій, які допомагають розв’язувати найскладніші клінічні задачі в різних галузях медицини, зокрема в щелепно-лицевій хірургії [16–19].
Застосування персоналізованого підходу до пацієнта з використанням комп’ютерного моделювання дозволяє отримати тривимірні моделі черепа для вивчення особливостей анатомії стінок орбіти та її об’єму, а також об’єму параорбітальної жирової клітковини й екстраокулярних м’язів, що потенційно можуть впливати на результат декомпресії та зменшення екзофтальму, а також на появу інтраопераційних ускладнень (травматизація судинно-нервових пучків, м’язів та ін.).
У дослідженні морфометричних показників 140 орбіт, визначених за допомогою комп’ютерного 3D-моделювання на основі даних комп’ютерних томографій (КТ) орбіт, Kamer et al. відзначили значне міжіндивідуальне коливання об’єму орбіти від 18,9 до 33,4 мл, об’єму очного яблука від 6,0 до 10,1 мл, кута орбітального конуса від 39,7° до 65,7°. Саме через значну варіабельність морфологічних параметрів орбіт при застосуванні стандартних підходів результати в різних пацієнтів можуть значно відрізнятися [20–22].
У першому ретроспективному когортному дослідженні Gladilin Е. et al. проаналізовано дані 3D-томографії 6 пацієнтів до та після операції декомпресії орбіти із застосуванням дослідницького біомеханічного моделювання орбітальної механіки для визначення факторів, що впливають на індивідуальний результат для кожного пацієнта (рисунки 2, 3) [23].
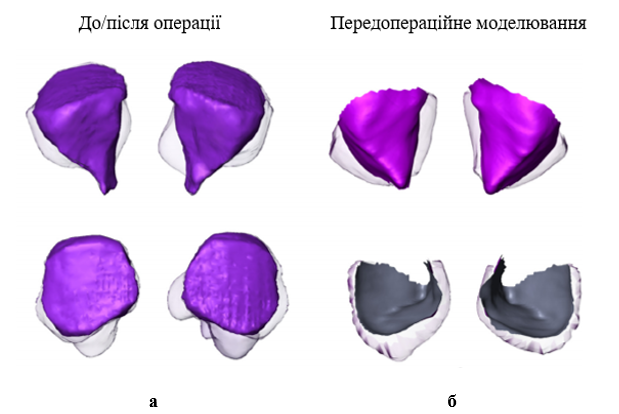
Рисунок 2. Порівняння орбітального простору до/після операції та передопераційне моделювання розширення трьох орбітальних стінок: а – прозорі поверхні вказують на сегментовані вручну ділянки, що відповідають жировій тканині, яка вивільняється з очного простору після резекції стінок орбіти; б – прозорі поверхні вказують на змодельоване заповнення простору жировою тканиною після резекції трьох орбітальних стінок
Виявлено велику мінливість зміщення очного яблука залежно від величини об’єму орбіти, що частково можна описати за допомогою обчислювального моделювання.
Детальний аналіз показав, що пацієнти з регулярною жировою тканиною демонструють хорошу кореляцію між зміщенням очного яблука та відносним об’ємом декомпресованої тканини. На відміну від цього, у пацієнтів з фіброзними змінами тканин відзначено значно менше зміщення очного яблука у відповідь на хірургічну декомпресію орбіти, яке складніше математично обчислити і передбачити.
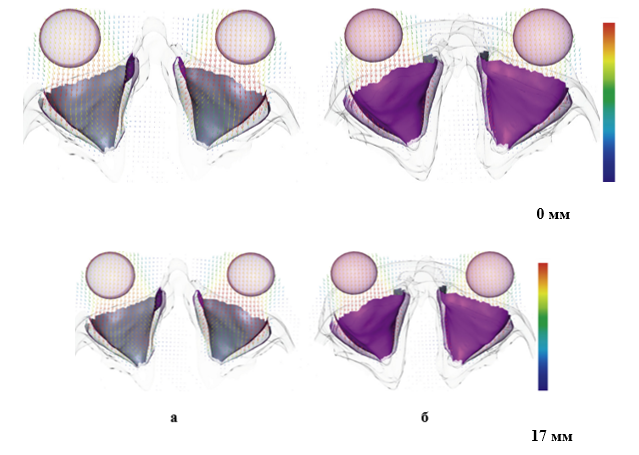
Рисунок 3. Моделювання кінцевого переміщення очного яблука після резекції трьох орбітальних стінок. Вигляд зверху (а) і знизу (б) поперечних зрізів 3D-моделі голови пацієнта. Синьо-червона кольорова карта вказує на величину переміщення відповідно в діапазоні 0–17 мм
Значну кількість наукових робіт на тему використання комп’ютерного моделювання та розробки хірургічних навігаційних шаблонів для проведення хірургічної декомпресії орбіти опубліковано на сьогодні, проте який об’єм втручання (точна площа кісткових фрагментів, їх кількість, об’єм параорбітальної жирової клітковини) слід виконати, щоб точно зменшити екзофтальм на необхідну величину, поки не встановлено. Це питання відкрите для подальших наукових досліджень.
Отже, призначення кортикостероїдів, променева терапія, хірургічне лікування – основні методи, які використовують для ведення хворих з ЕО з метою покращення якості життя пацієнтів. Персоналізований підхід до проведення хірургічної декомпресії орбіти з використанням комп’ютерного моделювання дає змогу спланувати оперативне втручання відповідно до морфологічних особливостей орбіти кожного пацієнта, проте цей напрям потребує подальших досліджень і вдосконалення для отримання оптимальних прогнозованих функціональних та естетичних результатів лікування.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
REFERENCES
- Kahaly GJ, Bartalena L, Hegedüs L, Leenhardt L, Poppe K, Pearce SH. 2018 European Thyroid Association guideline for the management of Graves’ hyperthyroidism. Eur Thyroid J. 2018;7(4):167-186. https://doi.org/10.1159/000490384.
- Bartalena L, Baldeschi L, Boboridis K, Eckstein A, Kahaly GJ, Marcocci C, et al. The 2016 European Thyroid Association/European Group on Graves’ orbitopathy guidelines for the management of Graves’ orbitopathy. Eur Thyroid J. 2016 Mar; 5(1):9-26. https://doi.org/10.1159/000443828.
- Ross DS, Burch HB, Cooper DS, Greenlee MC, Laurberg P, Maia AL, et al. 2016 American Thyroid Association guidelines for diagnosis and management of hyperthyroidism and other causes of thyrotoxicosis. Thyroid. 2016 Oct;26(10):1343-1421. https://doi.org/10.1089/thy.2016.0229.
- Ткаченко ВІ, Максимець ЯА, Видиборець НВ, Коваленко ОФ. Аналіз поширеності тиреоїдної патології та захворюваності на неї серед населення Київської області та України за 2007 – 2017 рр. Міжнародний ендокринологічний журнал. 2018;14(3):279-284. Tkachenko VI, Maksymets YaA, Vydyborets NV, Kovalenko OF. [Analysis of the prevalence and morbidity of thyroid pathology among the populationof Kyiv region and Ukraine for 2007–2017]. Mìžnarodnij endokrinologìčnij žurnal (International Journal of Endocrinology). 2018;14(3):279-284. Ukrainian. https://doi.org/10.22141/2224-0721.14.3.2018.136426
- Черенько МС. Безпечність пульс-терапії глюкокортикоїдними гормонами у лікуванні ендокринної орбітопатії. Клінічна ендокринологія та ендокринна хірургія. 2018;3(63):34-40. Cherenko MS. [Safety of pulse therapy with glucocorticoid hormones in the treatment of endocrine orbitopathy]. Clinical Endocrinology and Endocrine Surgery. 2018;3(63):34-40. Ukrainian. https://doi.org/10.24026/1818-1384.3(63).2018.142675
- Smith TJ, Hegedüs L. Graves’ disease. N Engl J Med. 2016 Oct 20;375(16):1552-1565.
- Smith TJ, Janssen JAMJL. Insulin-like growth factor-I receptor and thyroid-associated ophthalmopathy. Endocr Rev. 2019 Feb 1;40(1):236-267. https://doi.org/10.1210/er.2018-00066.
- Tsui S, Naik V, Hoa N, Hwang CJ, Affyan NF, Sinha Hikim A, et al. Evidence for an association between thyroid-stimulating hormone and insulin-like growth factor 1 receptors: a tale of two antigens implicated in Graves’ disease. J Immunol. 2008;181(6):4397-4405. https://doi.org/10.4049/jimmunol.181.6.4397.
- Bahn RS. Graves’ ophthalmopathy. N Engl J Med. 2010;362(8):726-738. https://doi.org/10.1056/NEJMra0905750.
- Mourits MP, Koornneef L, Wiersinga WM, Prummel MF, Berghout A, van der Gaag R. Clinical criteria for the assessment of disease activity in Graves’ ophthalmopathy: a novel approach. Br J Ophthalmol. 1989;73(8):639-644. https://doi.org/10.1136/bjo.73.8.639.
- Tanda ML, Piantanida E, Liparulo L, Veronesi G, Lai A, Sassi L, et al. Prevalence and natural history of Graves’ orbitopathy in a large series of patients with newly diagnosed Graves’ hyperthyroidism seen at a single center. J Clin Endocrinol Metab. 2013;98:1443-1449. https://doi.org/10.1210/jc.2012-3873.
- Terwee CB, Dekker FW, Mourits MP, Gerding MN, Baldeschi L, Kalmann R, et al. Interpretation and validity of changes in scores on the Graves’ ophthalmopathy quality of life questionnaire (GO-QOL) after different treatments. Clinical Endocrinology 2001 Mar;54(3):391-398. https://doi.org/10.1046/j.1365-2265.2001.01241.x.
- Iacobaeus L, Sahlin S. Evaluation of quality of life in patients with Graves´ ophthalmopathy, before and after orbital decompression. Orbit. 2016;35(3):121-125. https://doi.org/10.1080/01676830.2016.1176049.
- Sellari-Franceschini S, Dallan I, Bajraktari A, Fiacchini G, Nardi M, Rocchi R, et al. Surgical complications in orbital decompression for Graves’ orbitopathy. Acta Otorhinolaryngol Ital. 2016;36(4):265‐274. https://doi.org/10.14639/0392-100X-1082.
- Leong SC, Karkos PD, Macewen CJ, White PS. A systematic review of outcomes following surgical decompression for dysthyroid orbitopathy. Laryngoscope. 2009;119(6):1106-1115. https://doi.org/10.1002/lary.20213.
- Chepurnyi Y, Chernogorskyi D, Kopchak A, Petrenko O. Clinical efficacy of peek patient-specific implants in orbital reconstruction. J Oral Biol Craniofac Res. 2020;10(2):49-53. https://doi.org/10.1016/j.jobcr.2020.01.006.
- Chepurnyi Yu, Chernogorskyi D, Petrenko O, Kopchak A. Reconstruction of posttraumatic orbital defects and deformities with custom-made patient-specific implants: evaluation of the efficacy and clinical outcome. Craniomaxillofac Trauma Reconstruction Open. 2019;3(1):e9-e17. https://doi.org/10.1055/s-0039-1685505.
- Chepurnyi Y, Chernohorskyi D, Prykhodko D, Poutala A, Kopchak A. Reliability of orbital volume measurements based on computed tomography segmentation: Validation of different algorithms in orbital trauma patients. J Craniomaxillofac Surg. 2020;48(6):574-581. https://doi.org/10.1016/j.jcms.2020.03.007.
- Hierl T, Huempfner-Hierl H, Sterker I, Krause M. Decompression in endocrine orbitopathy with a navigated piezosurgical bone grinder. Br. J. Oral Maxillofac. Surg. 2017 Apr;55(3):330-332. https://doi.org/10.1016/j.bjoms.2016.09.008.
- Kamer L, Noser H, Schramm A, Hammer B, Kirsch E. Anatomy-based surgical concepts for individualized orbital decompression surgery in Graves orbitopathy. I. Orbital size and geometry. Ophthal Plast Reconstr Surg. 2010 Sep-Oct;26(5):348-352. https://doi.org/10.1097/IOP.0b013e3181c9bb52.
- Kamer L, Noser H, Kirsch E, Hammer B. Anatomy-Based Surgical Concepts for Individualized Orbital Decompression Surgery in Graves Orbitopathy. II. Orbital Rim Position and Angulation. Ophthal Plast Reconstr Surg. 2012 Jul-Aug;28(4):251-5. https://doi.org/10.1097/IOP.0b013e31824ddbfd.
- Borumandi F, Hammer B, Noser H, Kamer L. Classification of orbital morphology for decompression surgery in Graves’ orbitopathy: two-dimensional versus three-dimensional orbital parameters. Br J Ophthalmol. 2013 May;97(5):659-662. https://doi.org/10.1136/bjophthalmol-2012-302825. Epub 2013 Feb 21. PMID: 23428985.
- Gladilin E, Hierl T, Sterker I, Hümpfner-Hierl H, Hemprich A, Krause M. Retrospective cohort study of three-wall orbital resection for treatment of endocrine orbitopathy using 3D tomographic data and biomechanical modeling. Clin Biomech (Bristol, Avon). 2020 Jan;71:86-91. https://doi.org/10.1016/j.clinbiomech.2019.10.015. Epub 2019 Oct 29. PMID: 31707189.
Стаття надійшла в редакцію 16.02.2021 р.
Рецензія на статтю надійшла в редакцію 26.02.2021 р.