- Автор: Super User
- Категорія: № 2 (07) 2017
- Опубліковано: 17 квітня 2018
- Перегляди: 4616
УДК 617.735−02:616.379−008.64:612.017.1
https://doi.org/10.30702/Ophthalmology.2017/07.art4
Витовская О. П.1, Таха Салах Ахмад1, Клименко П. П.2
1Национальный медицинский университет им. А. А. Богомольца, г. Киев, Украина
2ГУ «Институт геронтологии им. Д. Ф. Чеботарева» НАМН Украины, г. Киев, Украина
Резюме. В представленном исследовании проведен анализ активности генов VEGF, TNF-alfa, Ang-1, IL-10 в биоптатах конъюнктивы глаза больных c сахарным диабетом (СД) 2-го типа с непролиферативной диабетической ретинопатией (НПДР). В исследование было включено 55 пациентов (110 глаз), которые были разделены на две группы: первая – контрольная группа составила 20 пациентов (40 глаз); вторая – больные с СД 2-го типа с НПДР составила 35 пациентов (70 глаз).
Полученные результаты свидетельствуют о росте активности генов VEGF и TNF-alfa в биоптатах конъюнктивы глаза больных с НПДР, при СД 2-го типа, а также об угнетении активности генов Ang-1 и IL-10.
Ключевые слова: сахарный диабет 2-го типа, непролиферативная диабетическая ретинопатия, VEGF – сосудистый эндотелиальный фактор роста, Ang-1 – ангиопоетин-1, IL-10 – интерлейкин-10, TNF-alfa – фактор некроза опухолей-альфа, HIF-1 – индуцируемый гипоксией фактор-1.
ВВЕДЕНИЕ
По прогнозам Международной диабетической федерации к 2030 году ожидается увеличение численности больных с cахарным диабетом 2-го типа (СД2) до 552 млн человек [11].
Одним из основных осложнений, вызванных СД, является диабетическая ретинопатия (ДР). По данным эпидемиологического исследования, на 2012 год на планете насчитывалось 93 млн больных с непролиферативной ДР, 17 млн – с пролиферативной ретинопатией, 21 млн – с диабетическим макулярным отеком и 28 млн – с ДР, угрожающей зрению [15]. При ДР происходят следующие патологические изменения в микроциркуляторном русле (МЦР) сетчатки: развиваются микроаневризмы, повышается проницаемость сосудистой стенки, наблюдается окклюзия сосудов, отмечается патологический ангиогенез и пролиферация соединительной ткани. Наблюдаемая пролиферация МЦР сетчатки может быть вызвана воздействием ангиогенного фактора VEGF [9], количество которого увеличивается в тканях глаза при ДР [12]. Основным стимулом к ангиогенезу при физиологических и патологических состояниях является недостаток кислорода (гипоксия или ишемия), который через индуцируемый гипоксией фактор-1 (HIF-1) запускает экспрессию многих ангиогенов, прежде всего фактора роста эндотелия сосудов (VEGF) и его рецепторов (VEGFR1 и VRGFR2). VEGF избирательно стимулирует пролиферацию и миграцию эндотелиальных клеток, их предшественников и моноцитов, увеличивает сосудистую проницаемость, способствует вазодилатации через усиление продукции NO [1].
Активированные гипоксией иммунокомпетентные клетки сетчатки (макрофаги и клетки микроглии) продуцируют большое количество TNF-альфа. Этот провоспалительный цитокин, согласно данным литературы, является пусковым фактором для активации продукции IL-8, VEGF и МСР-1 в клетках сосудов сетчатки и/или глиальных ячейках, соседствующих с микрососудами, а также участвует в индукции экспрессии гена iNOS [14].
При СД наблюдается угнетение активности факторов, отвечающих за нормализацию ангиогенеза и угнетение воспалительных процессов, таких как ангиопоетин-1 (Ang-1), экспрессия которого уменьшается при увеличении концентрации глюкозы в крови [3], и интерлейкина-10 (IL-10) [13], относящегося к категории важнейших противовоспалительных цитокинов [6].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучение изменения концентрации VEGFc, VEGF-Total, Ang-1, IL-10, TNF-alfa в биоптате конъюнктивы у больных с СД 2-го типа с непролиферативной диабетической ретинопатией (НПДР).
МАТЕРИАЛЫ И МЕТОДЫ
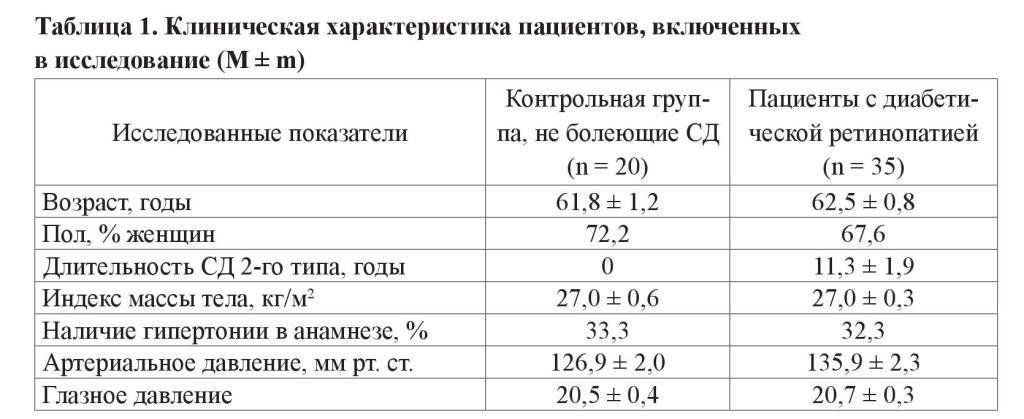
В исследование было включено 55 пациентов (110 глаз), которые были разделены на две группы: 1) контрольная, составила 20 пациентов (40 глаз), не болеющих СД; 2) больные с СД 2-го типа с НПДР, куда включили 35 пациентов (70 глаз).
Все пациенты были сопоставлены соответственно полу, возрасту и компенсации СД (таблица 1).
Во время операции у больных контрольной группы и у больных с СД 2-го типа была взята конъюнктива глаза. В ткани конъюнктивы глаза методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) было проведено определение уровня экспрессии генов VEGFc, VEGF-Total, Ang-1, IL-10, TNF-alfa.
Образцы ткани переносили в 0,75 мл лизирующего раствора (AmpliSens, Москва, Россия) и хранили в морозильной камере при –70 °C до проведения ПЦР.
В качестве маркерного гена (внутреннего контроля уровня экспрессии мРНК) использовали ген GAPDH (glyceroaldehydephosphate dehydrogenase).
РНК выделяли с использованием наборов «Рибо-золь» (AmpliSens, Москва, Россия) по стандартной процедуре (согласно инструкции). Для удаления следов геномной ДНК выделенные образцы обрабатывали 1 ед. RNase-free DNase (Sigma, USA) при 37 °C в течение 30 мин согласно инструкции к набору. ДНКазу инактивировали после добавления Stop-реагента инкубацией при 70 °C в течение 10 мин.
Реакцию обратной транскрипции проводили с использованием стандартных наборов «Реверта-L-100» («AmpliSens», Москва, Россия). К каждому образцу добавляли по 0,5 мкл 3’ и 5’ ген-специфического праймера. Последовательность использованных праймеров приведена в таблице 2. Реакционную смесь инкубировали при 37 °C в течение 30 мин.

Полимеразную цепную реакцию осуществляли после проведения реакции обратной транскрипции. Конечный объем смеси для амплификации в каждом образце составлял 10 мкл. Состав амплификационной смеси: по 0,5 мкл (1 мкг/мкл) каждого 3’ и 5’ ген-специфического праймера, 2 мкл dNTP (2 ммоль) 2 мкл DEPCобработанной воды, 10 мкл cDNA (образца после проведения реакции обратной транскрипции), 10 мкл верхней смеси для ПЦР (с Taq-полимеразой, 3 ммоль MgCl2). Все реагенты фирмы «AmpliSens» (Москва, Россия). Амплификацию проводили на термоциклере RotorGene-6000 (Сorbett Research, Австралия). Использовали горячий старт при 95 °C в течение 5 мин, затем проводили 40 циклов: денатурация при 94 °C – 10 с, отжиг при 60 °C – 10 с, удлинение при 72 °C – 10 с. Для подсчета уровня относительной экспрессии генов использовали метод ∆СТ. В качестве маркерного гена использовали ген GAPDH. Результаты представлены в виде кратности количества копий мРНК исследуемого гена по отношению к маркерному.
Статистическую обработку полученных данных выполняли с использованием программы Statistica 7.0 и программы Microsoft Excel. Для оценки значимости различий между группами людей использовали U-критерий Манна – Уитни.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В результате проведенного исследования уровня экспрессии генов гистогормонов в биоптатах конъюнктивы глаза, было показано увеличение экспрессии генов VEGF и TNF-alfa, участвующих в процессах ангиогенеза и неоваскуляризации [8], а также в развитии воспаления при ДР [4]. Увеличение экспрессии данных генов, возможно, объясняется взаимосвязью наблюдаемой между усилением активности TNF-alfa и VEGF [8].
Так, уровень экспрессии гена VEGF в контрольной группе соответствовал значению 1,74 у.е., а у больных с СД 2-го типа – 3,48 у.е. При этом не было выявлено статистически достоверного отличия в сравнении с контрольной группой. Уровень экспрессии гена провоспалительного цитокина TNF-alfa у больных с СД 2-го типа также возрастал и соответствовал значениям в контроле – 8,68 у.е. и при СД 2-го типа – 13,3 у.е. (таблица 3). Здесь также не было выявлено статистически значимых отличий между контрольной группой и больными с НПДР (таблица 3).
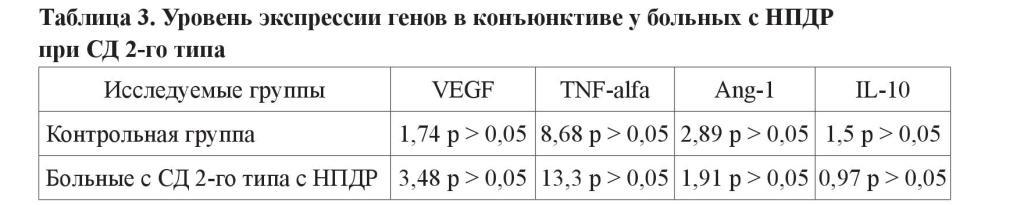
Значения экспрессии генов Ang-1 и IL-10, способствующих стабилизации структуры и функционированию сосудистой стенки и подавляющих воспалительные процессы [2, 10], уменьшались в биоптатах конъюнктивы больных с СД 2-го типа с НПДР. Величина экспрессии гена Ang-1 в контроле была 2,89 у.е., а при НПДР – 1,91 у.е. Экспрессия гена IL-10 характеризовалась значениями 1,5 у.е. – контроль и 0,97 у.е. − при НПДР. В экспрессии этих гистогормонов не отмечалось статистической разницы в сравнении с контрольной группой (таблица 3).
Таким образом, полученные данные свидетельствуют о возрастании в конъюнктиве больных с НПДР при СД 2-го типа активности генов гистогормонов VEGF, TNF-alfa, участвующих в развитии патологических процессов. Также эти результаты свидетельствуют о снижении при СД 2-го типа экспрессии гистогормонов Ang-1 и IL-10, отвечающих за стабилизацию стенки сосудов и обладающих антивоспалительным эффектом.
REFERENCES
- Poveshchenko АF, Konenkov VI. [Mechanisms and Factors of Angiogenesis]. Uspyekhi fiziologichyeskikh nauk. 2010;41(2):68–89. (in Russian).
- Halvorsen B, Wæhre T, Scholz H, Damås JK, Yndestad A, Aukrust P. Role of interleukin-10 in atherogenesis and plaque stabilization. Future Cardiology. 2006 Jan;2(1):75–83.
- Chen JX, Stinnett A. Disruption of Ang-1/Tie-2 signaling contributes to the impaired myocardial vascular maturation and angiogenesis in type II diabetic mice. Arterioscler Thromb Vasc Biol. 2008;28(9):1606–13.
- Costagliola С, Romano V, De Tollis M, Aceto F, dell’Omo R, Romano MR, Pedicino C, Semeraro F. TNF-Alpha Levels in Tears: A Novel Biomarker to Assess the Degree of Diabetic Retinopathy. Mediators of Inflammation. 2013;2013:1–6.
- Graves DT, Kayal RA. Diabetic complications and dysregulated innate immunity. Front Biosci. 2008;1(13):1227–39.
- Haddad JJ, Fahlman CS. Redox- and oxidant-mediated regulation of interleukin-10: an antiinflammatory, antioxidant cytokine? Biochemical and Biophysical Research Communications. 2002;297:163–76.
- Maloney JP, Gao L. Proinflammatory Cytokines Increase Vascular Endothelial Growth Factor Expression in Alveolar Epithelial Cells. Mediators of Inflammation. 2015;2015:1–7.
- Ohba T, Haro H, Ando T, Wako M, Suenaga F, Aso Y, Koyama K, Hamada Y, Nakao A. TNF-alpha-induced NF-kappaB signaling reverses age-related declines in VEGF induction and angiogenic activity in intervertebral disc tissues. J Orthop Res. 2009;27(2):229–35.
- Osaadon P, Fagan XJ, Lifshitz T, Levy J. A review of anti-VEGF agents for proliferative diabetic retinopathy. Eye (Lond). 2014;28(5):510–20.
- Thurston G, Rudge JS, Ioffe E, Zhou H, Ross L, Croll SD, Glazer N, Holash J, McDonald DM, Yancopoulos GD. Angiopoietin-1 protects the adult vasculature against plasma leakage. Nat Med. 2000;6(4):460–63.
- Unwin N, Whiting D, Guariguata L, Ghyoot G, Gan D. IDF Diabetes atlas. 5th ed. International Diabetes federation; 2011. 137 р.
- Wang X, Wang G, Wang Y. Intravitreous vascular endothelial growth factor and hypoxiainducible factor 1a in patients with proliferative diabetic retinopathy. Am J Ophthalmol. 2009;148(6):883–889.
- Yaghini N, Mahmoodi M, Asadikaram Gh R, Hassanshahi GhH, Khoramdelazad H, Kazemi Arababadi M. Serum Levels of Interleukin 10 (IL-10) in Patients with Type 2 Diabetes. Iran Red Crescent Med J. 2011;13(10):752.
- Yoshida S, Yoshida A, Ishibashi T. Induction of IL-8, MCP-1, and bFGF by TNF-alpha in retinal glial cells: implications for retinal neovascularization during post-ischemic inflammation. Graefes Arch Clin Exp Ophthalmol. 2004;242(5):409–13.
- Yau JW, Rogers SL, Kawasaki R, Lamoureux EL, Kowalski JW, Bek T, Chen SJ, Dekker JM, Fletcher A, Grauslund J, Haffner S, Hamman RF, Ikram MK, Kayama T, Klein BE, Klein R, Krishnaiah S, Mayurasakorn K, O’Hare JP, Orchard TJ, Porta M, Rema M, Roy MS, Sharma T, Shaw J, Taylor H, Tielsch JM, Varma R, Wang JJ, Wang N, West S, Xu L, Yasuda M, Zhang X, Mitchell P, Wong TY. Meta-Analysis for Eye Disease (META-EYE) Study Group. Global prevalence and major risk factors of diabetic retinopathy. Diabetes Care. 2012;35(3):556–64.
Стаття надійшла в редакцію 30.05.2017 р.
Рецензія на статтю надійшла в редакцію 21.06.2017 р.