- Автор: Super User
- Категорія: № 2 (07) 2017
- Опубліковано: 18 квітня 2018
- Перегляди: 4385
УДК 616.379−008.64+616−06/617.735
https://doi.org/10.30702/Ophthalmology.2017/07.art7
Сердюк В. Н.1, 2, Пилипенко Л. Ю.1, 3
1ГУ «Днепропетровская медицинская академия Министерства здравоохранения Украины», г. Днепр, Украина
2Днепропетровская областная клиническая офтальмологическая больница, г. Днепр, Украина
3Днепропетровская городская поликлиника № 4, г. Днепр, Украина
Резюме. У пациентов с метаболическим синдромом (МС) изучали концентрацию циркулирующего интерлейкина-8 крови на различных стадиях диабетической ретинопатии (ДРП) и провели сравнительную оценку влияния факторов прогрессии ДРП на его содержание в крови. Исследования проведены у 64 пациентов (95 глаз) с МС и ДРП (мужчины и женщины, средний возраст 61,55 ± 2,37 года, средний стаж сахарного диабета (СД) от момента регистрации 11,23 ± 2,11 лет, средний уровень гликированного гемоглобина (HbA1C) 9,89 ± 0,78 %, средний индекс массы тела (ИМТ) 34,55 ± 3,75 кг/м2), которых разделили на 3 группы в зависимости от стадии ДРП. Контрольная группа состояла из 23 лиц с ожирением без СД (мужчины и женщины, средний возраст 62,47 ± 4,73 года, средний ИМТ 31,87 ± 3,92 кг/м2). Показано, что модифицирующее влияние на уровень IL-8 в крови у больных с МС на пролиферативной стадии ДРП могут оказывать фактор возраста пациентов (до 60 лет), длительности СД (более 10 лет), субкомпенсация углеводного обмена и особенность терапии СД 2-го типа пероральными сахароснижающими препаратами (ПССП). Обнаружена статистически значимая негативная ассоциация (r = –0,29; R2 = 8,6 %; p = 0,03) уровня IL-8 в крови и возраста пациентов и тенденция (r = –0,25; R2 = 6,3 %; p = 0,06) к обратной зависимости длительности СД 2-го типа и концентрации IL-8 в крови пациентов с ДРП и МС. Сделан вывод о связи циркулирующего в крови IL-8 с развитием ДРП, особенно в возрасте пациентов до 60 лет.
Ключевые слова: диабетическая ретинопатия, интерлейкин-8, метаболический синдром.
ВВЕДЕНИЕ
Интерлейкин-8 (IL-8) – один из активных провоспалительных α-хемокинов, мощный хемоаттрактант, который принимает участие в регуляции ангиогенеза, реконструкции сосудов, играет важную роль в патогенезе различных видов воспаления, в частности хронического неспецифического системного субклинического (low-grade) воспаления, характерного для метаболического синдрома (МС), а также является важным патофизиологическим медиатором процессов коагуляции [19]. Согласно современным представлениям, IL-8 рассматривается как один из индикаторов повреждения эндотелия сосудов при сахарном диабете (СД) и как один из факторов формирования его макро- и микрососудистых осложнений, в том числе и пролиферативной диабетической ретинопатии (ДРП) [1–3, 10, 12]. Существует значительное увеличение системной экспрессии провоспалительных цитокинов, активации растворимых молекул адгезии клеточной поверхности и экспрессии хемокинов в сетчатке пациентов с ДРП [15]. Несколько клинических исследований свидетельствуют о том, что увеличение уровня провоспалительных цитокинов в сыворотке крови, молекул адгезии и активация иммунных клеток при диабете коррелирует с прогрессированием ДРП [8, 13].
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучение концентрации циркулирующего IL-8 крови на различных стадиях ДРП и проведение сравнительной оценки влияния факторов прогрессии ДРП на его содержание в крови при МС.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проведены у 64 пациентов (95 глаз) с МС и ДРП (мужчины и женщины, средний возраст 61,55 ± 2,37 года, средний стаж СД 11,23 ± 2,11 лет, средний уровень гликированного гемоглобина (HbA1C) 9,89 ± 0,78 %, средний индекс массы тела (ИМТ) 34,55 ± 3,75 кг/м2), которых разделили на 3 группы в зависимости от стадии ДРП. Контрольная группа состояла из 23 лиц с ожирением без СД (мужчины и женщины, средний возраст 62,47 ± 4,73 года, средний ИМТ 31,87 ± 3,92 кг/м2). Работа выполнена в соответствии с требованиями Хельсинской декларации Всемирной медицинской ассоциации (2008), приказами Министерства здравоохранения Украины № 281 от 01.11.2000 г., № 355 от 25.09.2002 г., № 1118 от 21.12.2012 г. Включение или невключение в исследование пациентов и волонтеров осуществляли согласно принятым в литературе рекомендациям [4]. У пациентов исследуемой и контрольной групп измеряли рост, массу тела, объем талии и бедер, рассчитывали ИМТ, регистрировали систолическое и диастолическое артериальное давление, в сыворотке крови определяли концентрации общего холестерина, холестерина липопротеидов высокой плотности (ХС ЛПВП), холестерина липопротеидов низкой плотности (ХС ЛПНП) и триглицеридов (ТГ), а также уровни глюкозы натощак и HbA1C (у пациентов с СД 2-го типа). Метаболический синдром определяли по Рабочим критериям экспертов Национального института здоровья США (Adult Treatment Panel III, ATP III, 2001), признанным ВОЗ, и консенсусу Всемирной федерации по изучению сахарного диабета (IDF) [7, 9]. Концентрацию глюкозы в плазме крови определяли глюкозооксидазным, а в капиллярной крови – ферментативным колориметрическим методами, концентрацию HbA1C в крови – методом жидкостной ионообменной хроматографии высокого давления, концентрацию ТГ, общего ХС и его фракций – спектрофотометрическим методом. Концентрацию IL-8 в плазме крови определяли с помощью набора «Human Interleukin-8 ELISA kit» методом иммуноферментного анализа (ИФА) с использованием иммуноферментного анализатора «IEMS Reader MF» (Labsystems, Финляндия). Согласно набору, уровень референсных значений для IL-8 в плазме крови составляет 9,75–1250 пг/мл. В других наборах человеческого IL-8 референсные значения составляют 15,6–1000 пг/мл, а также 62,5– 2000 пг/мл с нижним пределом определения в 5 пг/мл и 25 пг/мл, что указывает на отсутствие универсальной нормы концентрации IL-8 в крови. Поэтому мы следовали инструкции выбранного набора и сравнивали полученные результаты с уровнем 9,75 пг/мл. Уровнем сравнения HbA1C с учетом пациент-ориентированного подхода и ожидаемой продолжительности жизни был избран менее 8 % [14]. Выделяли следующие типы сахароснижающей терапии: 1-й – диета и прием пероральных сахароснижающих препаратов (ПССП), 2-й – инсулинотерапия. Всем пациентам проводилось комплексное офтальмологическое обследование с применением авторефрактометрии, визометрии, тонометрии, периметрии, биомикроскопии, фотографирования глазного дна и флюоресцентной ангиографии глазного дна (по показаниям). Диагноз ДРП выставляли согласно приказу МЗ Украины от 22.05.2009 г. № 356 в редакции приказа МЗ Украины от 05.08.2009 г. № 574, в котором рекомендуют выделять 3 основных стадии ДРП: непролиферативную, препролиферативную и пролиферативную. Статистическую обработку проводили с помощью одно- и двухфакторного дисперсионного и регрессионного анализа. Применяли параметрический критерий Фишера или непараметрический критерий Крускала – Уоллиса. Характеристиками регрессионных моделей считали: r – коэффициент корреляции, R2 – коэффициент детерминации, p – уровень статистической значимости моделей. Статистические характеристики представлены в виде среднего арифметического (M) и стандартной ошибки (± m), 95 % доверительного интервала (95 % ДИ). Статистически значимыми различия считали, если р < 0,05. Статистический анализ данных проводился с помощью компьютерной программы «SPSS 9.0». Вычисления и построение графиков кривых выполняли в статистическом компьютерном пакете Statgraphics 3 для Windows.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ
Уровень циркулирующего IL-8 в крови больных с МС на разных стадиях ДРП представлен в таблице 1. Как показали результаты дисперсионного анализа, показатели IL-8 крови превышали уровень референсных значений (менее 9,75 пг/мл) как в контрольной группе (лица с ожирением), так и на всех стадиях ДРП у больных с СД 2-го типа и МС с наибольшим средним значением (82,6 пг/мл) на ІІІ стадии ДРП (в том числе и по ДИ – 109,9 пг/мл). Отмечено градуальное (на І и ІІІ стадиях ДРП) повышение концентрации IL-8 в крови по сравнению с контролем. Если при ожирении степень повышения уровня IL-8 составляла 5,6 раза (по ДИ – 7,2 раза), то на І и ІІІ стадиях ДРП степень превышения референсных значений была больше и составляла 7,6 раза и 8,2 раза соответственно (по ДИ – 8,9 раза и 10,9 раза соответственно), что указывает на негативную направленность выявленных изменений концентрации IL-8.
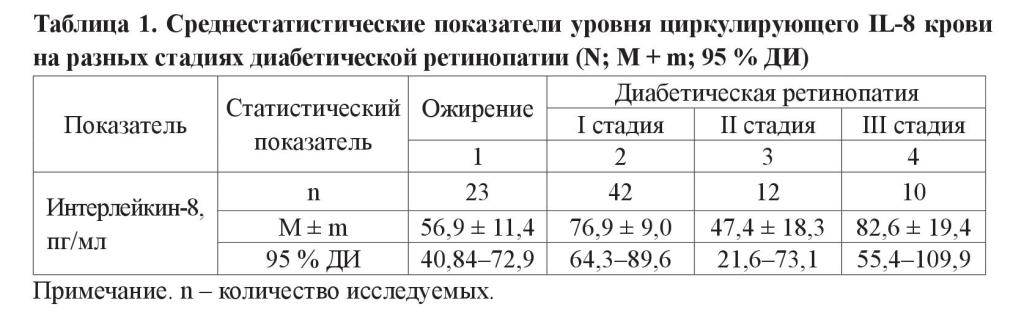
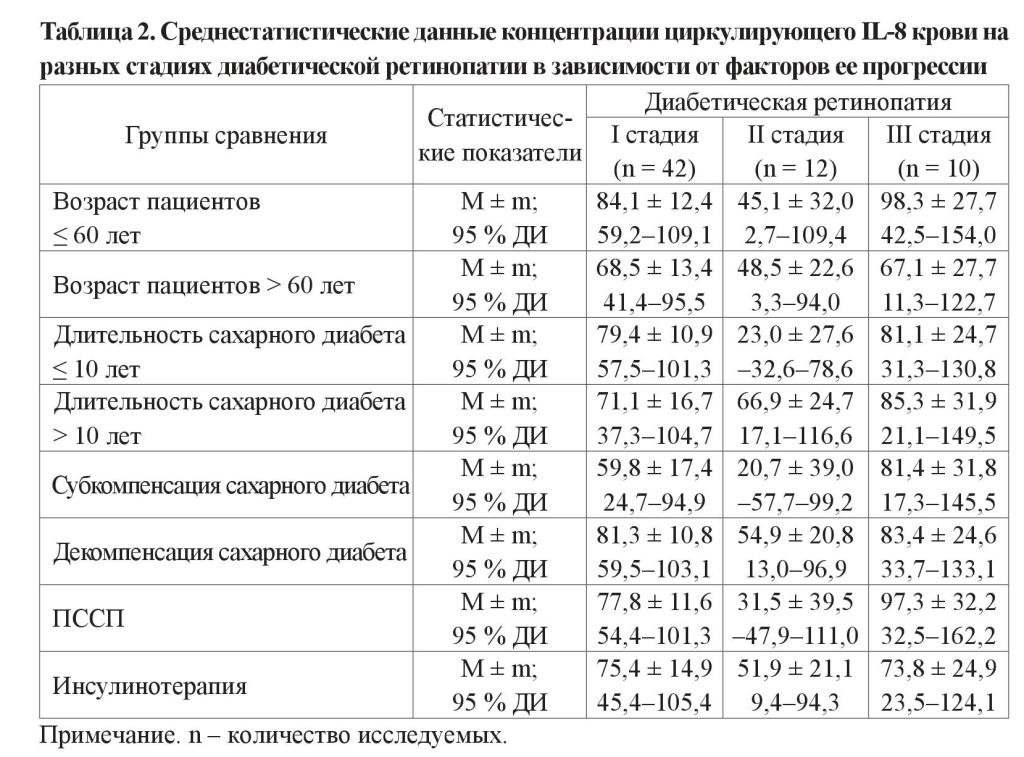
Уровни циркулирующего IL-8 крови больных с МС с учетом факторов прогрессии ДРП представлены в таблице 2. Показано, что в возрасте до 60 лет наибольший средний уровень IL-8 был на ІІІ стадии ДРП, а в возрасте свыше 60 лет – на І и ІІІ стадиях ДРП. Наихудший уровень IL-8 в данных группах сравнения наблюдался у пациентов в возрасте до 60 лет на ІІІ стадии ДРП (98,3 пг/мл, а по ДИ – 154,0 пг/мл). Отмечается превышение референсных значений концентрации IL-8 в 8,4 раза на І стадии, в 9,8 раза (наибольшая степень увеличения) на ІІІ стадии ДРП в возрасте пациентов до 60 лет и в 6,7–6,8 раза на І и на ІІІ стадиях ДРП в возрасте пациентов более 60 лет.
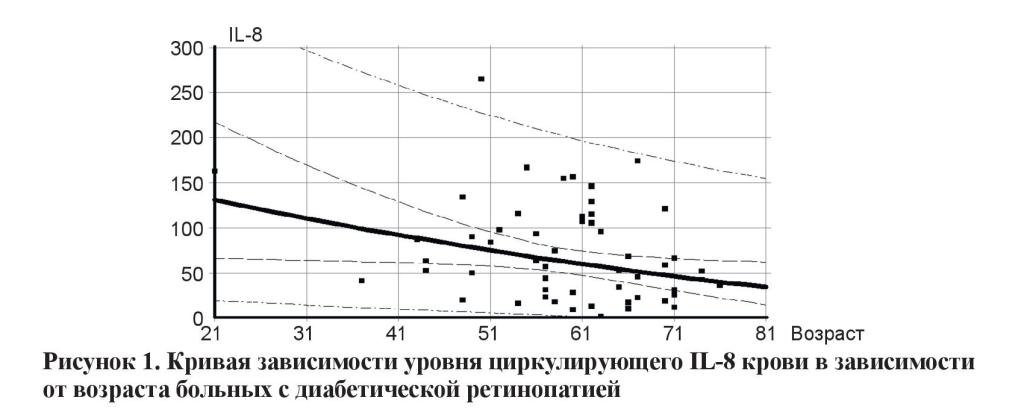
Учитывая данные регрессионного анализа, уровень IL-8 у пациентов с СД 2-го типа и ДРП различной степени тяжести (n = 54) статистически значимо (p = 0,03) снижался с возрастом пациентов. Параметры регрессионной кривой следующие: r = –0,29; R2 = 8,6 % (рисунок 1).
У пациентов с длительностью СД до 10 лет наибольший средний уровень IL-8 был на І и ІІІ стадиях ДРП, а у больных с длительностью диабета более 10 лет – на ІІІ стадии ДРП. Наихудший средний уровень IL-8 в данных группах сравнения отмечается у пациентов с длительностью СД более 10 лет на ІІІ стадии ДРП (85,3 пг/мл, а по ДИ – 149,5 пг/мл). Выявляется превышение рекомендуемых значений концентрации IL-8 в 7,9 раза на І стадии, в 2,3 раза на ІІ стадии, в 8,1 раза на ІІІ стадии ДРП при длительности СД до 10 лет и в 7,1 раза на І стадии, в 6,6 раза на ІІ стадии ДРП и в 8,5 раза (наибольшая степень увеличения) на ІІІ стадии ДРП при длительности СД более 10 лет.
По данным регрессионного анализа, влияние длительности СД 2-го типа на уровень IL-8 у пациентов на различных стадиях ДРП (n = 54) имело выраженную тенденцию к обратной зависимости (r = –0,25; R2 = 6,3 %; p = 0,06).
У больных с уровнем HbA1C ≤ 8 % наибольший средний уровень IL-8 был у пациентов на ІІІ стадии ДРП, а при HbA1C более 8 % – на І и ІІІ стадиях ДРП. Относительно наихудший средний уровень IL-8 в данных группах сравнения наблюдался у больных с HbA1 > 8 % на ІІІ стадии ДРП (83,4 пг/мл), хотя эти данные очень близки к І стадии ДРП при HbA1C > 8 % и к ІІІ стадии ДРП при HbA1C ≤ 8 %. Наблюдается превышение приемлемых значений концентрации IL-8 в 5,9 раза на І стадии, в 2 раза на ІІ стадии, в 8,1 раза на ІІІ стадии ДРП при HbA1C ≤ 8 % и в 8,1 раза на І стадии, в 5,5 раза на ІІ стадии и в 8,3 раза (наибольшая степень увеличения) на ІІІ стадии ДРП у больных с HbA1C > 8 %. По данным регрессионного анализа нами не было выявлено статистически значимой зависимости содержания IL-8 от уровня HbA1c.
При терапии ПССП наибольший средний уровень IL-8 был у пациентов на ІІІ стадии ДРП, а при использовании инсулинотерапии – на І и ІІІ стадиях ДРП. Наихудший средний уровень IL-8 в представленных группах сравнения отмечается на ІІІ стадии ДРП у больных, получающих ПССП (97,3 пг/мл, а по ДИ – 162,2 пг/л). Выявляется превышение желаемых значений концентрации IL-8 в 7,8 раза на І стадии, в 3,2 раза на ІІ стадии, в 9,7 раза на ІІІ стадии ДРП (наибольшая степень увеличения) при лечении ПССП и в 7,5 раза на І стадии, в 5,2 раза на ІІ стадии и в 7,4 раза на ІІІ стадии ДРП при использовании инсулинотерапии.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
Как показали результаты исследования, концентрация IL-8 в крови закономерно превышала референсные значения как у лиц с ожирением, так и на всех стадиях ДРП. Выявлено градуальное (волнообразное) повышение концентрации IL-8 в крови от непролиферативной к пролиферативной стадии ДРП при превышении референсных значений в 8,9 раза. Отметим, что нижние границы ДИ контрольной и исследуемых групп даже не приближаются к уровню референсных значений, характерных для лиц без ожирения. По результатам сравнительной оценки влияния факторов прогрессии ДРП на показатели IL-8 крови у больных с СД 2-го типа укажем, что наиболее значительное его повышение (наихудший уровень) отмечается в возрасте пациентов до 60 лет (превышение уровня референсных значений практически в 10 раз), при длительности СД более 10 лет (здесь учитывается также наибольший ДИ), при субкомпенсации углеводного обмена (HbA1C менее 8 %) (здесь высокий ДИ), при использовании ПССП (наибольшее превышение референсных значений по средним величинам и ДИ) на пролиферативной стадии ДРП. Учитывая данные регрессионного анализа, найдена статистически значимая негативная ассоциация (разновидность корреляции или связи) уровня IL-8 и возраста пациентов с ДРП на фоне СД 2-го типа (p = 0,03).
Такие исследования, как Hoorn study, отметили важную роль субклинического воспаления в развитии ДРП [11, 16, 19]. В настоящее время установлено, что роль воспаления в патогенезе диабетической ретинопатии очевидна и, в тоже время, очень сложна. Следует отметить, что гипергликемия, оксидативный стресс, ускоренное формирование конечных продуктов гликозилирования и гипертония способствуют развитию воспаления, а сама воспалительная реакция поддерживает эти фундаментальные процессы дальше посредством именно цитокинов, молекул адгезии, сигнализации (Vascular Endothelial Growth Factor – VEGF), повышенной экспрессии RAGE (Receptor for Advanced Glycation Endproducts – RAGEs), изменений в регуляции синтеза оксида азота и сигнализации NF-kB (Nuclear Factor kappa-light-chain-enhancer of activated B cells). Субклиническое воспаление в сетчатке приводит к повышению внутриглазного давления крови с помощью эндотелиальной синтазы оксида азота (Endothelial Nitric Oxide Synthase – eNOS), формированию новых, слабых сосудов и их повышенной проницаемости под влиянием VEGF, что, в свою очередь, из-за взаимодействия нескольких провоспалительных факторов ведет к кровоизлияниям в сетчатку и лейкостазу. Лейкостаз инициирует капиллярную окклюзию и АФК-опосредованную гибель клеток (активные формы кислорода – АФК), а также усиление воспалительной реакции на местном уровне в тканях сетчатки. Принято считать, что дисфункция эндотелия и повышение уровня провоспалительных цитокинов и молекул адгезии способствуют лейкостазу путем усиления взаимодействия лейкоцитов и эндотелиальных клеток [5, 6, 17, 18].
Таким образом, собственные результаты созвучны с мнением о негативной роли системного низкоградуального воспаления и цитокинов, в том числе IL-8 [8, 13], в инициации и прогрессировании ДРП и дополняют данные Wisconsin epidemiologic study of diabetic retinopathy (WESDR) [16] о связи маркеров воспаления и эндотелиальной дисфункции в возникновении и развитии ДРП.
ВЫВОДЫ
Модифицирующее влияние на уровень IL-8 в крови у больных с МС на пролиферативной стадии ДРП могут оказывать фактор возраста пациентов (до 60 лет), длительности СД (более 10 лет), субкомпенсация углеводного обмена и особенность терапии СД 2-го типа (ПССП).
Обнаружена статистически значимая (p = 0,03) негативная ассоциация уровня IL-8 в крови и возраста пациентов и тенденция (p = 0,06) к обратной зависимости длительности СД 2-го типа и концентрации IL-8 в крови пациентов с ДРП и МС.
Авторы статьи декларируют отсутствие конфликта интересов.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
- Уровень циркулирующих цитокинов и хемокинов в доклиническую и раннюю клиническую стадии развития сахарного диабета 1А типа / К. П. Зак, С. В. Мельниченко, Е. Н. Тронько, Б. Н. Маньковский // Терапевтический архив. – 2010. – № 10. – C. 10–15.
- Зак К. П. Хемокины при сахарном диабете 1-го типа у человека / К. П. Зак, В. В. Попова // Укр. мед. часопис. – 2008. – № 6. – C. 69–78.
- Рівень циркулюючого хемокіну − інтерлейкіну-8 у передклінічний і ранній клінічній стадіях цукрового діабету 1-го типу у дітей / В. В. Попова, С. В. Мельниченко, К. П. Зак, Б. Н. Маньковський // Клінічна ендокринологія та ендокринна хірургія. – 2007. – № 2. – C. 38–41.
- Сердюк В. Н. Морфометрические и биохимические кластеры метаболического синдрома у пациентов с сахарным диабетом 2-го типа на разных стадиях диабетической ретинопатии / В. Н. Сердюк, В. А. Ищенко // Міжнародний ендокринологічний журнал. − 2016. − № 7(79). − С. 69−74.
- Activity of the glycosylating enzyme, core 2 GlcNAc (β1,6) transferase, is higher in polymorphonuclear leukocytes from diabetic patients compared with age-matched control subjects: relevance to capillary occlusion in diabetic retinopathy / R. Chibber, B. M. Ben-Mahmud, D. Coppini, [et al.] // Diabetes. − 2000. − Vol. 49(10). − P. 1724–1730.
- Protein kinase C β2-dependent phosphorylation of core 2 GlcNAc-T promotes leukocyteendothelial cell adhesion: a mechanism underlying capillary occlusion in diabetic retinopathy / R. Chibber, B. M. Ben-Mahmud, G. E. Mann, [et al.] // Diabetes. − 2003. − Vol. 52(6). − P. 1519–1527.
- Executive summary of the third report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) / [Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults] // JAMA. − 2001. − Vol. 285 (19). − P. 2486−2497.
- Сomparison of serum NO, TNF-α, IL-1β, sIL-2R, IL-6 and IL-8 levels with grades of retinopathy in patients with diabetes mellitus / S. Doganay, C. Evereklioglu, H. Er, [et al.] // Eye. − 2002. − Vol. 16(2). − P. 163–170.
- Diagnosis and Management of the Metabolic Syndrome: an American Heart Association / National Heart, Lung, and Blood Institute Scientific Statement / S. M. Grundy, J. I. Cleeman, S. R. Daniels, [et al.] // Circulation. − 2005. − Vol. 112. − P. 2735−2752.
- Vitreous Chemokines and Shou (Zheng in Chinese) of Chinese-Korean-Japanese medicine in patients with diabetic vitreoretinopathy / S. Hayasaka, X. Y. Zhang, H. S. Cui, [et al.] // Am. J Chin Med. − 2006. − Vol. 34(4). − P. 537–543.
- Inflammation and endothelial dysfunction are associated with retinopathy: the Hoorn study / M. V. van Hecke, J. M. Dekker, G. Nijpels, [et al.] // Diabetologia. −2005.−Vol. 48(7).−P. 1300–1306.
- Endothelial dysfunction and low-grade inflammation and the progression of retinopathy in type 2 diabetes / M. W. Spijkerman, M. A. Gall, L. Tarnow, [et al.] // Diabetic Medicine. − 2007. − Vol. 24(9). − P. 969–976.
- Chemokines as risk factors for type 2 diabetes: results from the MONICA/KORA Augsburg study, 1984−2002 / C. Herder, J. Baumert, B. Thorand, [et al.] // Diabetologia. − 2006. − Vol. 49(5). − P. 921–929.
- Interleukin-8, monocyte chemoattractant protein-1 and IL-10 in the vitreous fluid of patients with proliferative diabetic retinopathy / C. Hernández, R. M. Segura, A. Fonollosa, [et al.] // Diabetic Medicine. − 2005. − Vol. 22(6). − P. 719–722.
- Management of Hyperglycemia in Type 2 Diabetes, 2015: A Patient-Centered Approach: Update to a Position Statement of the American Diabetes Association and the European Association for the Study of Diabetes / S. Inzucchi, R. M. Bergenstal, J. B. Buse, [et al.] // Diabetes Care. − 2015. − Vol. 38(1). − P. 140–149.
- Is inflammation a common retinal-renal-nerve pathogenic link in diabetes? / A. H. Kaul, J. M. Tarr, E. M. Kohner, R. Chibber // Current Diabetes Reviews. − 2010. − Vol. 6(5). − P. 294–303.
- The relation of markers of inflammation and endothelial dysfunction to the prevalence and progression of diabetic retinopathy: Wisconsin epidemiologic study of diabetic retinopathy / E. K. Klein, M. D. Knudtson, M. Y. Tsai, R. Klein // Archives of Ophthalmology. − 2009. − Vol. 127(9). − P. 1175–1182.
- Lutty G. A. Relationship of polymorphonuclear leukocytes to capillary dropout in the human diabetic choroid / G. A. Lutty, J. Cao, D. S. McLeod // American Journal of Pathology. − 1997. − Vol. 151(3). − P. 707–714.
- Schroder S. Activated monocytes and granulocytes, capillary nonperfusion, and neovascularization in diabetic retinopathy / S. Schroder, W. Palinski, G. W. Chmid-Schonbein // American Journal of Pathology. − 1991. − Vol. 139(1). − P. 81–100.
REFERENCES
- Zak KP, Mel’nichenko SV, Tronko EN. [The level of circulating cytokines and chemokines in the preclinical and early clinical stage of the development of type 1A diabetes mellitus]. Terapevticheskij arhiv. 2010;10:10–15. (in Russian).
- Zak KP, Popova VV. [Chemokines with type 1 diabetes mellitus in humans]. Ukr Med Chasopys. 2008;6:69–78. (in Russian).
- Popova VV, Melnichenko SV, Zak KP, Mankovskij BN. [The level of circulating chemokine − interleukin-8 in the pre-clinical and early clinical stages of type 1 diabetes in children]. Klinichna endokrynolohiia ta endokrynna khirurhiia. 2007;2:38–41. (in Urainian).
- Serdyuk VN, Ishhenko VA. [Morphometrial and biochemical clusters of metabolic syndrome in patients with type 2 diabetes mellitus at different stages of diabetic retinopathy]. Mizhnarodnyi endokrynolohichnyi zhurnal. 2016;7(79):69−74. (in Russian).
- Chibber R, Ben-Mahmud BM, Coppini D, Christ E, Kohner EM. Activity of the glycosylating enzyme, core 2 GlcNAc (β1,6) transferase, is higher in polymorphonuclear leukocytes from diabetic patients compared with age-matched control subjects: relevance to capillary occlusion in diabetic retinopathy. Diabetes. 2000;49(10):1724–30.
- Chibber R, Ben-Mahmud BM, Mann GE, Zhang JJ, Kohner EM. Protein kinase C β2-dependent phosphorylation of core 2 GlcNAc-T promotes leukocyte-endothelial cell adhesion: a mechanism underlying capillary occlusion in diabetic retinopathy. Diabetes. 2003;52(6):1519–27.
- Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive summary of the third report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA. 2001;285:2486−97.
- Doganay S, Evereklioglu C, Er H, Türköz Y, Sevinç A, Mehmet N, Savli H. Сomparison of serum NO, TNF-α, IL-1β, sIL-2R, IL-6 and IL-8 levels with grades of retinopathy in patients with diabetes mellitus. Eye. 2002;16(2):163–70.
- Grundy SM, Cleeman JI, Daniels SR, Donato KA, Eckel RH, Franklin BA, Gordon DJ, Krauss RM, Savage PJ, Smith SC Jr, Spertus JA, Costa F. Diagnosis and Management of the Metabolic Syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Circulation. 2005;112:2735−52.
- Hayasaka S, Zhang XY, Cui HS, Yanagisawa S, Chi ZL, Hayasaka Y, Shimada Y. Vitreous Chemokines and Shou (Zheng in Chinese) of Chinese-Korean-Japanese medicine in patients with diabetic vitreoretinopathy. Am. J Chin Med. 2006;34(4):537–43.
- van Hecke MV, Dekker JM, Nijpels G, Moll AC, Heine RJ, Bouter LM, Polak BC, Stehouwer CD. Inflammation and endothelial dysfunction are associated with retinopathy: the Hoorn study. Diabetologia. 2005;48(7):1300–6.
- Spijkerman MW, Gall MA, Tarnow L, Twisk JW, Lauritzen E, Lund-Andersen H, Emeis J, Parving HH, Stehouwer CD. Endothelial dysfunction and low-grade inflammation and the progression of retinopathy in type 2 diabetes. Diabetic Medicine. 2007;24(9):969–76.
- Herder C, Baumert J, Thorand B, Koenig W, de Jager W, Meisinger C, Illig T, Martin S, Kolb H. Chemokines as risk factors for type 2 diabetes: results from the MONICA/KORA Augsburg study, 1984−2002. Diabetologia. 2006;49(5):921–29.
- Hernández C, Segura RM, Fonollosa A, Carrasco E, Francisco G, Simó R. Interleukin-8, monocyte chemoattractant protein-1 and IL-10 in the vitreous fluid of patients with proliferative diabetic retinopathy. Diabetic Medicine. 2005;22(6):719–722.
- Inzucchi S, Bergenstal RM, Buse JB, Diamant M, Ferrannini E, Nauck M, Peters AL, Tsapas A, Wender R, Matthews DR. Management of Hyperglycemia in Type 2 Diabetes, 2015: A Patient-Centered Approach: Update to a Position Statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care. 2015; 38(1):140–9.
- Kaul AH, Tarr JM, Kohner EM, Chibber R. Is inflammation a common retinal-renal-nerve pathogenic link in diabetes? Current Diabetes Reviews. 2010;6(5):294–303.
- Klein EK, Knudtson MD, Tsai MY, Klein R. The relation of markers of inflammation and endothelial dysfunction to the prevalence and progression of diabetic retinopathy: Wisconsin epidemiologic study of diabetic retinopathy. Archives of Ophthalmology. 2009;127(9):1175–82.
- Lutty GA, Cao J, McLeod DS. Relationship of polymorphonuclear leukocytes to capillary dropout in the human diabetic choroid. American Journal of Pathology. 1997;151(3):707–14.
- Schroder S, Palinski W, Chmid-Schonbein GW. Activated monocytes and granulocytes, capillary nonperfusion, and neovascularization in diabetic retinopathy. American Journal of Pathology. 1991;139(1):81–100.
Стаття надійшла в редакцію 20.11.2017 р.
Рецензія на статтю надійшла в редакцію 15.12.2017 р