- Автор: Super User
- Категорія: № 2 (07) 2017
- Опубліковано: 18 квітня 2018
- Перегляди: 5708
УДК [617.7−007.681−085.355+615.355](048.8)
Мишель Иестер
Oфтальмологическая клиника Университета Генуи, г. Генуя, Италия
Резюме. Бринзоламид представляет собой 1 % суспензию и показан для снижения внутриглазного давления (ВГД). Бринзоламид является высокоспецифичным, неконкурентным, обратимым и эффективным ингибитором карбоангидразы II (CAII), который способен уменьшать образование водянистой влаги в глазу и, таким образом, снижать ВГД. В нескольких клинических испытаниях была оценена его безопасность, а именно развитие глазных побочных эффектов: снижение зрения (3–8 %), глазной дискомфорт (1,8–5,9 %) и боль в глазах (0,7–4 %). Бринзоламид используется для лечения офтальмогипертензии и первичной открытоугольной глаукомы. В некоторых клинических исследованиях было показано, что бринзоламид снижал ВГД примерно на 18 %. Бринзоламид может быть добавлен к бетаблокаторам и аналогам простагландинов. В сочетании с аналогами простагландинов он способен повышать их эффективность, поскольку аналоги простагландинов улучшают увеосклеральный отток, увеличивая при этом активность карбоангид разы в цилиарном эпителии с вторичным повышением секреции водянистой влаги, что может незначительно снижать их эффективность. При этом топические ингибиторы карбоангидразы уменьшают ВГД за счет ингибирования CA-II рецепторов, что улучшает эффективность аналогов простагландинов, а также снижает ВГД. Бринзоламид может иметь дополнительное влияние на глазную гемодинамику. Некоторые клинические исследования показали умеренное улучшение ретробульбарного кровообращения. Теоретически, ингибиторы карбоангидразы могут вызвать метаболический ацидоз, при котором развивается вторичная вазодилатация, что способствует улучшению кровотока. Системный ацидоз может возникать при приеме системных ингибиторов карбоангидразы, а локальный ацидоз в тканях глаза теоретически возможен при применении топических ингибиторов карбоангидразы.
Топически применяемый ингибитор карбоангидразы эффективен в снижении ВГД в пределах от 15 до 20 %. Опубликованные данные свидетельствуют о том, что бринзоламид можно использовать в качестве препарата первой линии, даже если другие антиглаукомные препараты имеют более высокую эффективность. Бринзоламид характеризуется малым риском развития побочных эффектов и имеет дополнительные преимущества в лечении глаукомы. При некоторых типах глаукомы сосудистая дисрегуляция выражена в большей степени, поэтому топически применяемые ингибиторы карбоангидразы могут оказать двойной эффект: уменьшение ВГД и улучшение кровообращения в тканях глаза.
Ключевые слова: бринзоламид, офтальмогипертензия, глаукома, внутриглазное давление, глазной кровоток, безопасность, лечение.
Бринзоламид представляет собой белый порошок, нерастворимый в воде, выпускаемый в форме 1 % суспензии и применяется для снижения внутриглазного давления (ВГД).
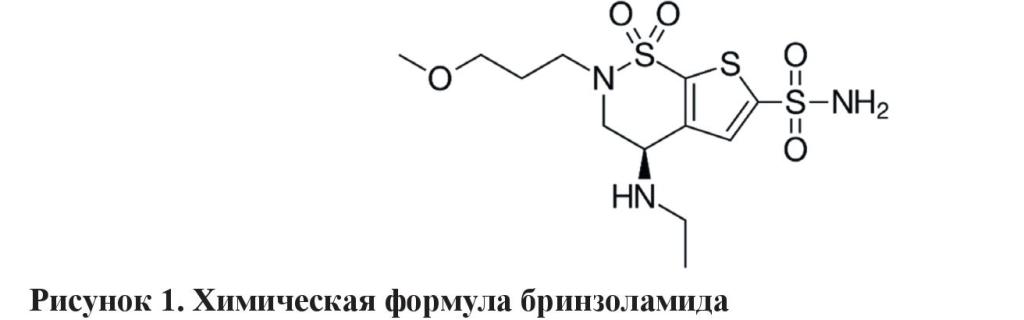
Химическая формула бринзоламида – C12H21N3O5S3 (рисунок 1) [9, 50].
Эффективность бринзоламида 0,3–3 % оценивалась в нескольких рандомизированных, двойных, слепых, многоцентровых, сравнительных, клинических испытаниях [34, 38, 45, 49, 53, 54].
Исследование взаимосвязи концентрации и эффективности, сравнивающее бринзоламид в концентрациях 0,3, 1, 2 и 3 % продемонстрировало среднее снижение ВГД на 3 мм рт. ст. (11,3 %), 4,3 мм рт. ст. (16,1 %), 4,4 мм рт. ст. (16,1 %) и 4,2 мм рт. ст. (15,4 %) соответственно. При измерении суточного ВГД, бринзоламид 1 или 3 % уменьшает ВГД значительно лучше, чем бринзоламид 0,3 % [54].
Наблюдения показали, что оптимальная терапевтическая концентрация для уменьшения ВГД составляла 1 %. Рекомендованной частотой дозирования является 3 раза в день в США и 2 раза в день в ЕС и Японии. Тем не менее, исследования III фазы показали, что 1 % бринзоламид приводит к статистически значимому снижению ВГД от исходного уровня, и что оба режима использования клинически эквивалентны друг другу [34, 49, 53].
Бринзоламид является специфическим, неконкурентным, обратимым и эффективным ингибитором карбоангидразы II типа (CA-II) [10], способным подавлять образование водянистой влаги в глазу и, таким образом, снижать ВГД. Он может катализировать обратимую реакцию воды и двуокиси углерода (CO2) для образования отрицательно заряженных ионов бикарбоната [35]. Для достижения фармакологических эффектов требуется ингибирование CA-II [28, 35].
Бринзоламид имеет время полураспада – 3–5 ч. Роговица действует как депо, обеспечивающее устойчивое высвобождение лекарственного средства в цилиарное тело [28, 35]. В тканях человека имеется 7 различных изоферментных форм карбоангидразы, из которых наиболее активной является СА-II. Она встречается главным образом в эритроцитах, почках, поджелудочной железе, тканях глаза, центральной нервной системе и легких [35]. В глазу CA-II встречается преимущественно в цилиарном теле, эндотелиальных клетках роговицы и пигментном эпителии.
В эндотелии роговицы CA-II играет роль фермента, поддерживающего относительно дегидратированное состояние стромы роговицы. Ингибирование этого механизма может привести к развитию декомпенсации патологии роговицы и отеку со вторичным нарушением зрения.
В рандомизированном, двойном, слепом, клиническом исследовании 372 пациента с глаукомой и глазной гипертензией получали бринзоламид 1 % или тимолол 0,5 %. Через 18 месяцев лечения не было обнаружено значимых изменений в толщине роговицы и плотности эндотелиальных клеток роговицы [34]. Однако в это исследование были включены только здоровые люди с неизмененной роговицей. Некоторую озабоченность вызывает вопрос использования ингибиторов карбоангидразы у пациентов с повреждениями роговицы, так как в двух опубликованных исследованиях сообщалось о случаях декомпенсации патологического процесса роговицы у пациентов с кератопатией после лечения дорзоламидом [1, 29].
После всасывания бринзоламид связывается с тканями глаза, что было продемонстрировано в исследованиях на здоровых добровольцах [10]. В настоящее время доказано, что бринзоламид, поступая в кровеносное русло, связывается преимущественно с CA-II в эритроцитах, составляя концентрацию свободного бринзоламида в плазме ниже определяемого уровня. В эритроцитах требуется менее 1 % активности CA-II для поддержания физиологических функций [34]. Таким образом, в эритроцитах концентрация ингибиторов карбоангидразы была недостаточной для полного насыщения CA-II. В почках концентрация свободного бринзоламида недостаточна для ингибирования CA-II в проксимальных канальцах. Таким образом, риск развития системного метаболического ацидоза минимален (см. ниже). Кроме того, низкая аффинность бринзоламида к другим формам изофермента карбоангидразы и низкая концентрация в плазме крови может объяснить низкую частоту развития системных побочных эффектов после местного применения данной группы препаратов [34].
В нескольких клинических исследованиях была оценена безопасность бринзоламида 1 % [37, 45, 49, 53, 59, 60, 61]. Наиболее частыми глазными побочными явлениями были: помутнение зрения (3–8 %), глазной дискомфорт (1,8–5,9 %) и боль в глазах (0,7–4 %). Другие побочные явления, возникающие с частотой менее чем 3 %, включали гиперемию, зуд, блефарит, кератит, ощущение инородного тела, сухость глаз, конъюнктивит.
Zhau J. C. и Chen T. (2005) сообщили о двух случаях декомпенсации патологии роговицы через 15 месяцев и 2 года регулярного применения бринзоламида. Отек роговицы был обратим и имел обратное развитие после прекращения лечения. Однако истинная причина этого была сложна для оценки, так как в последующем ни у одного пациента не было отмечено изменение центральной толщины роговицы [59].
Наиболее распространенным системным побочным эффектом было изменение вкуса, возникающее у 3–7,8 % пациентов [45, 49, 53]. Не было клинически значимых изменений частоты сердечных сокращений, артериального давления и в результатах лабораторных исследований картины крови, биохимических показателей крови и мочи. Кроме того, средняя концентрация углекислого газа в эритроцитах была снижена только до 51–55 %. Лишь один случай системного метаболического ацидоза был описан Menon G. J. и Vernon S. A. (2006).
Бринзоламид используется для лечения офтальмогипертензии и первичной открытоугольной глаукомы (ПОУГ), которые характеризуются двумя основными патогенетическими аспектами – повышением ВГД и повреждением структур зрительного нерва.
Глаукома – это многофакторная оптическая нейропатия, характеризующаяся прогрессирующей потерей ганглиозных клеток сетчатки и их аксонов. Клинически она проявляется глаукоматозным поражением зрительного нерва с постепенным увеличением эскавации, с прогрессирующим истончением нейроретинального слоя и утратой визуальных полей зрения. Было определено, что пациент может потерять до 35 % оптических нервных волокон до момента обнаружения первого дефекта визуальных полей зрения с использованием стандартной автоматизированной периметрии [41, 60].
Офтальмогипертензия характеризуется повышением ВГД без каких-либо изменений поля зрения, зрительного нерва и изменения количества нервных волокон сетчатки [11]. Другими словами, офтальмогипертензия может быть первым шагом к развитию глаукомы у большинства пациентов. Однако не все случаи офтальмогипертензии переходят в глаукому, что было доказано при исследовании исходов офтальмогипертензии. При этом, независимо от того, принимали ли пациенты с офтальмогипертензией антигипертензивные препараты или нет, через 5–7 лет у некоторых развилась глаукома [57]. Очевидно, что процент возникновения глаукомы будет отличаться у пациентов, получающих антигипертензивную терапию и без нее. Так, процент пациентов с офтальмогипертензией, получавших терапию, у которых развилась глаукома, был меньше и составлял 5 % против 9 % случаев развития глаукомы у пациентов, не получавших терапию [26]. Однако до сих пор остается неясным, когда и какие пациенты с офтальмогипертензией нуждаются в терапии.
Как у пациентов с ПОУГ, так и при офтальмогипертензии, основным фактором риска прогрессирования заболевания остается повышенное ВГД, которое может вызвать повреждение зрительного нерва с последующим сужением поля зрения. Некоторые клинические испытания показали, что уменьшение ВГД может замедлить прогрессирование глаукомы [2, 7, 11, 21, 26, 33]. До сих пор, величина ВГД – единственный поддающийся лечению фактор риска [11]. Таким образом, лечение глаукомы базируется на снижении ВГД при помощи медикаментов, лазерного или хирургического лечения.
За последние несколько лет произошли изменения в выборе препаратов первой линии медикаментозной терапии. Шесть различных классов молекул, снижающих ВГД, в частности альфа-адренергические агонисты, бета-блокаторы, ингибиторы карбоангидразы, парасимпатомиметики, аналоги простагландинов и симпатомиметики. Эффективность отличается в зависимости от класса и колеблется от 30 % для простагландинов/простамидов до 18 % для топических ингибиторов карбоангидразы [11].
Для получения клинического эффекта все типы препаратов, снижающих ВГД, могут быть использованы в качестве препаратов первого выбора, согласно рекомендациям Европейского общества глаукомы. Если на фоне монотерапии не удается достичь целевых цифр ВГД, назначают дополнительный препарат. Кроме того, при отсутствии эффективности, допустима замена одного монопрепарата на другой из доступных на рынке.
Важно понимать не только цели терапии, но и механизм действия, побочные эффекты и противопоказания каждого отдельного лекарственного средства [11]. Существует множество антиглаукомных препаратов. При этом выбор терапии должен учитывать качество жизни, стоимость и приверженность пациентов к терапии. Если для терапии используется более двух антигипертензивных препаратов, пациенту может быть рекомендовано лазерное или хирургическое лечение. Уровень, на который необходимо снижать ВГД, может отличаться в зависимости от исходных показателей.
Для замедления прогрессии глаукомы необходимо снизить ВГД не менее чем на 30 % от исходного уровня [7]. В исследовании AGIS было показано, что в группе пациентов, которые поддерживали ВГД на уровне 12 мм рт. ст. в течение 7-летнего периода наблюдения, изменения визуального поля зрения не прогрессировали [43]. Leske М. С. и соавторы (2007) провели исследование с оценкой в отдельных группах пациентов с более высоким и более низким исходным уровнем ВГД и с ранней манифестацией глаукомы для определения факторов риска прогрессирования до момента возникновения заболевания.
Пациенты с рано возникшей открытоугольной глаукомой были рандомизированы для проведения аргоновой лазерной трабекулопластики плюс бетаксолол или для медикаментозной терапии с обследованием каждые 3 месяца на протяжении 11 лет. Лечение и последующее наблюдение показало влияние на прогрессию глаукомы такого фактора риска, как ВГД, независимо от его исходной величины.
Другими значимыми факторами были: возраст, двустороннее поражение, эксфолиативный синдром и кровоизлияние в диск зрительного нерва. Низкое перфузионное систолическое давление и низкое систолическое артериальное давление, а также сердечно-сосудистые заболевания стали расцениваться как новые предикторы развития глаукомы, подчеркивая роль сосудистой дисрегуляции в прогрессировании глаукомы. Роль еще одного нового фактора риска – малой центральной толщины роговицы – продолжают изучать [33].
Также в исследованиях было отмечено, что антигипертензивные препараты предупреждают или препятствуют началу ПОУГ у лиц с офтальмогипертензией при отсутствии признаков глаукомного поражения зрительного нерва [11]. Эти данные показывают, что сокращение ВГД является фундаментальным для ПОУГ и офтальмогипертензии и позволяет отсрочить или предупредить развитие ПОУГ и прогрессирование заболевания. Бринзоламид можно использовать отдельно или в комбинации с другими препаратами для лечения таких пациентов.
Основной эффект бринзоламида связан со снижением ВГД: в цилиарном эпителии ингибируется СА-II, что замедляет образование ионов бикарбоната и их секрецию в заднюю камеру глаза. Это, в свою очередь, уменьшает транспортировку ионов натрия в заднюю камеру глаза, что приводит к снижению образования водянистой влаги и, как следствие, к снижению ВГД [35]. Интересно, что САII является высокоэффективным ферментом и было подсчитано, что для снижения выработки водянистой влаги и, как следствие, ВГД, необходимо подавить более чем 99 % активности карбоангидразы [35]. Эффективность бринзоламида 1 % и дорзоламида 2 % сравнивали у 25 нормальных субъектов: бринзоламид снижал объем циркуляции водянистой влаги в дневное время на 0,47 мкл/мин и в ночное время на 0,16 мкл/мин, в то время как дорзоламид снижал объем циркуляции водянистой влаги глаза на 0,34 мкл/мин и 0,10 мкл/мин соответственно. Однако не было достоверно значимой разницы в уменьшении объема циркуляции водянистой влаги для бринзоламида и дорзоламида [25].
В монотерапии
При проведении метаанализа клинических испытаний Van der Valk R. и соавторы (2005) оценили уровень снижения ВГД на фоне приема различных антигипертензивных препаратов и плацебо.
Было обнаружено, что наибольшее снижение ВГД, достигнутое при применении бринзоламида, составляло 17 %. Wang Т. Н. и соавторы (2004) провели небольшое перспективное, двойное, маскированное исследование, сравнивающее бринзоламид 1 % с тимололом 0,5 % у 50 пациентов с открытоугольной глаукомой. После 6 недель лечения ВГД снизилось на 4,8 мм рт. ст. (17 %) в группе бринзоламида и на 5,7 мм рт. ст. (19,7 %) в группе тимолола (p < 0,05).
Адъювантная терапия с бета-блокаторами
Shin D. (2000) сравнивал эффективность комбинированной терапии бринзоламида 1 % и тимолола 0,5 % с тимололом 0,5 % и плацебо у пациентов с открытоугольной глаукомой или офтальмогипертензией. Через 1 месяц после использования тимолола пациентам добавили либо бринзоламид, либо плацебо, с последующей оценкой результатов через 3 месяца. Среднее снижение ВГД после добавления бринзоламида к тимололу составляло от 3,3 до 4,1 мм рт. ст. (статистически достоверная разница по сравнению с исходными данными и плацебо).
Добавление к простагландину
Известно, что производные простагландинов улучшают увеосклеральный отток, но с другой стороны, они также увеличивают активность карбоангидразы в ресничном эпителии с вторичным увеличением выработки водянистой влаги, что может привести к снижению эффективности данного класса препаратов [36].
Теоретически, топические ингибиторы карбоангидразы снижают ВГД, ингибируя CA-II, за счет чего также они могут улучшить эффект аналогов простагландинов [10]. В неконтролируемом, открытом исследовании у пациентов (n = 14) с ПОУГ к однократно вводимому латанопросту 0,005 % добавляли бринзоламид. Был достигнут клинический эффект в снижении ВГД (p < 0,01) на 20, 21,1 и 23,5 % после 1, 2 и 3 месяцев лечения соответственно [51]. Подобные результаты были получены у пациентов с глаукомой нормального давления. Nakamoto К. и Yasuda N. (2007) сравнивали эффективность латанопроста в одном глазу с латанопростом плюс бринзоламид в другом глазу. Было продемонстрировано значительно большее уменьшение суточного (p < 0,001), ночного (p < 0,05) и среднего циркадного ВГД в группе латанопрост и бринзоламид (17,1 %), чем в группе монотерапии латанопростом (13,6 %).
В многоцентровом, рандомизированном, двойном, маскированном, параллельном, групповом, сравнительном исследовании Franks W. и соавторы (2006) сравнили эффект бринзоламида 1 % или тимолола 0,5 % при добавлении к травопросту. Через 3 месяца было достигнуто значительное снижение ВГД без достоверной разницы показателей в группах сравнения. Hollo G. и соавторы (2006) обнаружили, что пациенты, которые получали комбинированную терапию травопростом 0,004 % и бринзоламидом 1 %, достигли более низких значений ВГД, чем при монотерапии травопростом (p < 0,0001). Результатом комбинированной терапии стал значительно больший процент пациентов, достигших ВГД 18 мм рт. ст. и менее (p < 0,0001).
Feldman R. M. и соавторы (2007) сравнили эффективность бринзоламида 1 % с бримонидином 0,15 % при добавлении к травопросту один раз в день: после 3 месяцев лечения уменьшение ВГД на 2,7 мм рт. ст. было достигнуто в группе бринзоламида и на 2,1 мм рт. ст. в группе бримонидина (p = 0,035).
Reis R. и соавторы (2006) сравнили эффект бринзоламида 1 %, бримонидина 0,2 % или тимолола 0,5 % дважды в день, при добавлении к однократно используемому травопросту 0,004 %. Среднее снижение ВГД, наблюдаемое при использовании бринзоламида составило (4,2 мм рт. ст., 22,7 %), что было статистически эквивалентно тимололу (3,9 мм рт. ст., 20,2 %) (p < 0,05) и оба они были значительно выше (p < 0,02), чем у бримонидина (2,3 мм рт. ст., 13,4 %).
Martinez-de-la-Casa J. M. и соавторы (2004) сравнили эффективность комбинированной терапии травопростом один раз в день с бринзоламидом два раза в день по сравнению с однократным применением фиксированной комбинации латанопрост/ тимолол. Среднее снижение суточного ВГД было меньше в группе травопрост плюс бринзоламид, чем в группе латанопрост/тимолол через 1 месяц (p = 0,041), 2 месяца (p = 0,046) и 3 месяца (p = 0,015). Различия ВГД варьировали от 0,8 до 1,2 мм рт. ст.
Опубликованные данные свидетельствуют, что патофизиология глаукомы многофакторна и нарушение кровообращения играет значительную роль в прогрессировании заболевания [4, 32, 42, 56]. Низкое диастолическое перфузионное давление было связано с более высокой заболеваемостью глаукомой в популяционном исследовании. Кровоизлияние в диск зрительного нерва было идентифицировано как фактор риска развития болезни в нескольких исследованиях [5, 32]. Кроме того, состояния, приводящие к вазоспазму иногда обнаруживаются у пациентов с глаукомой, особенно при глаукоме с нормальным давлением. Сосудистая дисрегуляция может быть одним из наиболее важных прогностических факторов для исследования у некоторых пациентов. Непостоянная перфузия диска зрительного нерва может активировать выработку некоторых молекул, которые обычно не образуются или содержатся в минимальных количествах [17]. Как показали Schulzer М. и Drance S. M. (1987), деление глаукомы на глаукому с нормальным ВГД и тяжелую глаукому на основании только одного показателя – ВГД на уровне 21 мм рт. ст. не является правильным, так как существуют другие факторы риска, согласно которым все случаи ПОУГ можно разделить на подгруппы. Аналогичные результаты с использованием другого подхода были получены Nicolela M. T. и Drance S. M. (1996), которые рассмотрели около 1000 снимков диска зрительного нерва глаукомных пациентов, чтобы разделить их на 4 подгруппы: очаговая ишемическая, старческая, миопическая глаукома и глаукома с концентрической выемкой. Они выбрали около 100 снимков дисков зрительных нервов, которые были включены в одну из этих четырех подгрупп. Сверили особенности клинической картины для каждой подгруппы и нашли существенные различия в значениях ВГД, симптомах вазоспазма и в дефектах визуальных полей зрения. Они определили, что ВГД является наиболее значимым фактором риска, однако и другие факторы риска играют существенную роль в патогенезе глаукомы.
Бринзоламид может оказывать опосредованное влияние на глазную гемодинамику. Sampaolesi J. и соавторы (2001) сравнивали кровообращение в диске зрительного нерва в здоровых глазах, при офтальмогипертензии и при глаукоме. В результате исследования было обнаружено, что кровоток был снижен при офтальмогипертензии и при глаукоме. Бринзоламид восстанавливал гемодинамику в диске зрительного нерва до уровня, сравнимого со здоровыми глазами.
Kothy P. и Hollo G. (2001) исследовали in vivo потенциальное влияние различных препаратов на диаметр артериол сетчатки здоровых добровольцев и пациентов с глаукомой с использованием анализатора сосудов сетчатки (RVA, Imedos GmbH, Веймар, Германия) и не обнаружили значительных изменений диаметра артериол через 2 часа после инстилляции антиглаукомых препаратов (например, бринзоламида 1 %, тимолола 0,5 %, бетаксолола 0,5 %, бримонидина 0,2 %, латанопроста 0,005 %).
Siesky B. и соавторы (2006) обнаружили, что пациенты с ПОУГ на фоне приема бринзоламида имели более высокие показатели диастолического перфузионного давления, чем пациенты, получающие дорзоламид. Тринадцать пациентов приняли участие в маскированном, перекрестном исследовании длительностью 3 месяца, на протяжении которых они принимали ежедневно терапию с использованием каждого препарата в правый и левый глаз. Не было статистически значимой разницы в величине ВГД, частоте сердечных сокращений, среднем артериальном давлении или систолическом артериальном давлении, но диастолическое перфузионное давление было выше в левых глазах (бринзоламид), чем в правых (дорзоламид).
При проведении флуометрии сетчатки в проспективном исследовании у 20 пациентов с глаукомой Iester М. (2003) обнаружил, что после лечения бринзоламидом помимо снижения ВГД на 19 %, наблюдалось сопутствующее улучшение кровообращения в верхней и нижней перипапиллярных областях сетчатки. Улучшение кровотока сетчатки варьировало от 13,15 до 16,6 %. В исследовании на 30 здоровых волонтерах Kaup М. и др. (2004) обнаружили, что не было значительных изменений ретробульбарной гемодинамики при измерении методом цветного допплеровского картирования в группе бринзоламида. Однако методом видеоангиографии с использованием флуоресцеина было обнаружено значительное улучшение времени артериовенозного пассажа по сравнению с плацебо.
Теоретически, ингибиторы карбоангидразы могут вызвать метаболический ацидоз с вторичной вазодилатацией и улучшением кровотока. Системный ацидоз может возникать при использовании системных ингибиторов карбоангидразы, а локальный ацидоз в тканях глаза теоретически возможен при применении топических препаратов, что также может увеличить локальное кровообращение [28]. И системные, и топические ингибиторы карбоангидразы улучшают глазные параметры [3, 18], так как они приводят к изменению концентрации CO2 и уровня pH [55]. Увеличение объема тканевой концентрации CO2 может способствовать местной вазодилатации. Кроме того, несколько авторов обнаружили, что ацетазоламид способен дозозависимо увеличивать мозговой кровоток за счет развития внеклеточного ацидоза [12, 20, 44, 48, 58].
Топические ингибиторы карбоангидразы способны накапливаться в эритроцитах из-за высокого сродства к некоторым белкам эритроцитов и плазмы [8, 18]. Было показано, что топические ингибиторы карбоангидразы не повлияли на ретробульбарную гемодинамику, в то же время они увеличивали скорость кровотока в сетчатке, снижали индекс резистентности и увеличивали скорость кровотока в капиллярной сети диска зрительного нерва.
Несколько исследований показали разную скорость глазного кровотока у здоровых субъектов и пациентов с глаукомой [15, 16]. Эпидемиологические исследования продемонстрировали повышенный риск развития глаукомы при снижении перфузии тканей глаза [4, 56]. Следовательно, вторичный вазоактивный эффект бринзоламида может быть полезен при глаукоме, поскольку увеличивается количество доказательств того, что у пациентов с глаукомой имеет место сосудистая дисрегуляция и снижение перфузионного давления, которые являются важными факторами риска [6, 18, 19].
В заключение, использование топических ингибиторов карбоангидразы обладает эффективностью в снижении ВГД, которое колеблется от 15 до 20 %. Опубликованные данные показывают, что бринзоламид можно использовать в качестве препаратов первой линии, даже если другие лекарства обладают более высокой эффективностью, и что он может быть использован как дополнительная терапия. У тех пациентов, у которых ВГД должно быть уменьшено более чем на 30 %, бринзоламид можно комбинировать с аналогами простагландинов или с бета-блокаторами. В ближайшем будущем будут использоваться новые фиксированные комбинации с бринзоламидом. В частности, он будет сочетаться с бета-блокатором или с аналогами простагландинов. В фиксированной комбинации с тимололом обе молекулы снижают выработку водянистой влаги, а при комбинации с аналогами простагландинов снижение ВГД достигается благодаря сочетанию двух различных механизмов действия. Например, топический ингибитор карбоангидразы подавляет активность СА-II, на которую аналоги простагландинов действуют стимулирующе [39, 50].
У некоторых пациентов с глаукомой имеет место сосудистая дисрегуляция, поэтому топические ингибиторы карбоангидразы могут оказать двойной эффект: уменьшить ВГД и улучшить глазной кровоток. Однако этот вопрос требует дальнейшего изучения, так как существует вероятность того, что улучшение глазного кровотока может быть связано со снижением ВГД.
REFERENCES
- Adamson I. Irreversible corneal decompensation in patients treated with topical dorzolamide. Am J Ophthalmol. 1999;128:774–5.
- AGIS Investigators. The Advanced Glaucoma Intervention Study (AGIS): 7. The relationship between control of intraocular pressure and visual field deterioration. Am J Ophthalmol. 2000;130:429–40.
- Barnes GE, Wilhelm F, Schoch C. Increased optic nerve head blood flow after 1 week of twice daily topical brinzolamide treatment in Dutch-belted rabbits. Surv Ophthalmol. 2000; 44:131–40.
- Bonomi L, Marchini G, Maraffa M, et al. Vascular risk factors for primary open angle glaucoma. Ophthalmology. 2000;107:1287–93.
- Budenz DL, Anderson DR, Feuer WJ, et al. Detection and prognostic significance of optic disc hemorrhages during the Ocular Hypertension Treatment Study. Ophthalmology. 2006; 113:2137–43.
- Carlsson AM, Chauhan BC, Lee AA, et al. The effect of brimonidinetartrate on retinal blood flow in patients with ocular hypertension. Am J Ophthalmol. 2006;129:297–301.
- Collaborative Normal-Tension Glaucoma Study Group. The effectiveness of intraocular pressure reduction in the treatment of normal-tension glaucoma. Am J Ophthalmol. 1998; 126:498–505.
- Costa VP, Harris A, Stefansson E, et al. The effects of antiglaucomatous and systemic medications on ocular blood flow. Progr Retin Eye Res. 2003;22:769–805.
- Cvetkvic RS, Perry CM. Brizolamide. A review of its use in the management of Primary open-angle glaucoma and ocular hypertension. Drug Aging. 2003;20:919–47.
- DeSantis L. Preclinical overview of brinzolamide. Surv Ophthalmol. 2000;44(Suppl 2): S119–S129.
- European Glaucoma Society. Terminology and Guidelines. Savona: Dogma. 2003.
- Faraci FM, Heistad DD, Mayham WG, et al. Role of larger arteriesin regulation of blood flow to the brain stem in cats. J Physiol. 1987;387:112–5.
- Feldman RM, Tanna AP, Gross RL, et al. Comparison of the ocularhypotensive effi cacy of adjunctive brimonidine 0.15 % or brinzolamide 1 % in combination with travoprost 0.004 %. Ophthalmology. 2007;114:1248–54.
- Franks W. Ocular hypotensive efficacy and safety of brinzolamide ophthalmic suspension 1 % added to travoprost ophthalmic solution 0.004 % therapy in patients with open-angle glaucoma or ocular hypertension. Curr Med Res Opin. 2006;22:1643–9.
- Galassi F, Nuzzaci G, Sodi A, et al. Color Doppler imaging in evaluationof optic nerve blood supply in normal and glaucomatous subjects. Int Ophthalmol. 1992;16:273–6.
- Gherghel D, Orgul S, Gugleta K, et al. Relation between ocular perfusion and retrobulbar blood flow in patients with glaucoma with progressive damage. Am J Ophthalmol. 2000; 130:597–605.
- Grieshaber MC, Mozaffarieh M, Flammer J. What is the link between vascular dysregulation and glaucoma? Surv Ophthalmol. 2007;52(2):144–54.
- Harris A, Arend O, Arend S, et al. Effects of topical dorzolamide on retinaland retrobulbar hemodynamics. Acta Opthalmol Scand. 1996;74:569–72.
- Harris A, Arend O, Kagemann L, et al. Dorzolamide, visual functionand ocular hemodynamics in normal tension glaucoma. J Ocular PharmTher. 1999;15:189–97.
- Hauge A, Nicolaysen G, Thoresen M. Acute effects of acetazolamide on cerebral blood flow in man. Acta Physiol Scand. 1983;117:233–9.
- Heijl A, Leske MC, Bengtsson B, et al. Reduction of intraocular pressure and glaucoma progression: results from the Early ManifestGlaucoma Trial. Arch Ophthalmol. 2002;120: 1268–79.
- Hollo G, Chiselita D, Petkova N, et al. The efficacy and safety of timolol maleate versus brinzolamide each given twice daily added totravoprost in patients with ocular hypertension or primary open-angleglaucoma. Eur J Ophthalmol. 2006;16:816–23.
- Iester M, Altieri M, Michelson G, et al. Retinal peripapillary blood flow before and after topical brinzolamide. Ophthalmologica. 2003;218:390–6.
- Iester M. Brinzolamide. Expert Opin Pharmacother. 2008;9:653–62.
- Ingram CJ, Brubaker RF. Effect of brinzolamide and dorzolamide onaqueous humor flow in human eyes. Am J Ophthalmol. 1999;128:292–6.
- Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002;120:701–13.
- Kaup M, Plange N, Niegel M, et al. Effects of brinzolamide on ocularhaemodynamics in healthy volunteers. Br J Ophthalmol. 2004;88:257–62.
- Kaur IP, Smitha R, Deepika A, et al. Acetazolamide: future perspectivein topical glaucoma therapeutics. Int J Pharm. 2002;248:1–14.
- Konowal A, Morrison JC, Brown SVL, et al. Irreversible corneal decompansation in patients treated with topical dorzolamide. Am J ophthalmol. 1999;127:403–6.
- Kothy P, Hollo G. Does glaucoma medication influence the diameter of the retinal arteriole in the human eyes? (A pilot study using the retinalvessel analyser). Aca Phisiol Hungarica. 2001;88:281–92.
- Leske MC, Connell AM, Wu SY, et al. Risk factors for open-angle glaucoma. The Barbados Eye Study. Arch Ophthalmol. 1995;113:918–24.
- Leske MC, Heijl A, Hussein M, et al. Factors for glaucoma progression and the effect of treatment: the early manifest glaucoma trial. Arch Ophthalmol. 2003;121:48–56.
- Leske MC, Heijl A, Hyman L, et al. EMGT Group. Predictorsof long-term progression in the early manifest glaucoma trial. Ophthalmology. 2007;114:1965–72.
- March WF, Ochsner KI. The long-term safety and efficacy of brinzolamide 1.0 % (azopt) in patients with primary open-angle glaucoma orocular hypertension. The Brinzolamide LongTerm Therapy Study Group. Am J Ophthalmol. 2000;129:136–43.
- Maren TH. Carbonic anhydrase: chemistry, physiology, and inhibition. Physiol Rev. 1967; 47:595–781.
- Martinez-de-la-Casa JM, Castillo A, Garcia-Feijoo J, et al. Concomitant administration of travoprost and brinzolamide versus fixedlatanoprost/timolol combined therapy: three-month comparison of efficacy and safety. Curr Med Res Opin. 2004;20:1333–9.
- Menon GJ, Vernon SA. Topical brinzolamide and metabolic acidosis. Br J Ophthalmol. 2006;90:247–8.
- Michaud JE, Friren B. Comparison of topical brinzolamide 1 % anddorzolamide 2 % eye drops given twice daily in addition to timolol 0.5 % in patients with primary open-angle glaucoma or ocular hypertension. Am J Ophthalmol. 2001;132:235–43.
- Nakamoto K, Yasuda N. Effect of concomitant use of latanoprost and brinzolamide on 24- hour variation of IOP in normal-tension glaucoma. J Glaucoma. 2007;16:352–7.
- Nicolela MT, Drance SM. Various glaucomatous optic nerve appearances: clinical correlations. Ophthalmology. 1996;103:640–9.
- Pederson JE, Anderson DR. The mode of progressive disc cupping inocular hypertension and glaucoma. Arch Ophthalmol. 1980;98:490–5.
- Quigley HA, West SK, Rodriguez J, et al. The prevalence of glaucoma in a population-based study of Hispanic subjects: Proyecto VER. Arch Ophthalmol. 2001;119:1819–26.
- Reis R, Queiroz CF, Santos LC, et al. A randomized, investigatormasked, 4-week study comparing timolol maleate 0.5 %, brinzolamide 1 %, and brimonidine tartrate 0.2 % as adjunctive therapies to travoprost 0.004 % in adults with primary open-angle glaucoma or ocular hypertension. Clin Ther. 2006;28:552–9.
- Ringelstein EB, Van Eyck S, Mertens I. Evaluation of cerebral vasomotor reactivity by various vasodilating stimuli: comparison of CO2 to acetazolamide. J Cerebral Blood Flow. 1992;12:162–8.
- Sall K. The efficacy and safety of brinzolamide 1 % ophthalmic suspension (Azopt) as a primary therapy in patients with open-angle glaucoma or ocular hypertension. Brinzolamide Primary Therapy Study Group. Surv Ophthalmol. 2000;44(2):155–162.
- Sampaolesi J, Tosi J, Darchuk V, et al. Antiglaucomatous drugs effectson optic nerve head flow: design, baseline and preliminary report. Int Ophthalmol. 2001;23:359–67.
- Schulzer M, Drance SM. Intraocular pressure, systemic blood pressure, and age: a correlational study. Br J Ophthalmol. 1987;71:245–9.
- Severinghaus JW, Cotev S. Carbonic acidosis and cerebral vasodilatation after diamox. Scand J Clin Lab Invest. 1968;22:1E.
- Shin D. Adjunctive therapy with brinzolamide 1 % ophthalmic suspension (Azopt) in patients with open-angle glaucoma or ocular hypertension maintained on timolol therapy. Surv Ophthalmol. 2000;44(2):163–168.
- Shoji N, Ogata H, Suyama H, et al. Intraocular pressure lowering effect of brinzolamide 1 % as adjunctive therapy to latanoprost 0.005 % in patients with open angle glaucoma or ocular hypertension: an uncontrolled, open-label study. Curr Med Res Opin. 2005;21:503–8.
- Shoji N. Brinzolamide: efficacy, safety and its role in the management of glaucoma. Expert Rev Ophthalmol. 2007;2:695–704.
- Siesky B, Lin T, Kagemann L, et al. Comparison of three months treatment with dorzolamide and brinzolamide on perfusion pressuresin primary open angle glaucoma patients. 6th International Symposium on Ocular Pharmacology and Therapeutics; 2006 March 30 −Apr 2; Berlin, Germany. Berlin; 2006.
- Silver LH. Clinical efficacy and safety of brinzolamide (Azopt), a new topical carbonic anhydrase inhibitor for primary open-angle glaucoma and ocular hypertension. Brinzolamide Primary Therapy Study Group. Am J Ophthalmol. 1998;126:400–8.
- Silver LH. Dose-response evaluation of the ocular hypotensive effect of brinzolamide ophthalmic suspension (Azopt). Brinzolamide Dose-Response Study Group. Surv Ophthalmol. 2000;44(2):147–53.
- Sponsel WE, Shipman DL. The role of blood gases in ocular perfusion. In: Drance S, Chauhan B, editors. Ocular blood flow. Amsterdam: Kugler; 1997. Vol. 3.
- Tielsch JM, Katz J, Sommer A, et al. Hypertension, perfusion pressure, and primary openangle glaucoma. A population-based assessment. Arch Ophthalmol. 1995;113:216–21.
- Van der Valk R, Webers CAB, Schouten JSAG, et al. Intraocular pressure-lowering effects of all commonly used glaucoma drugs. A metaanalysis of randomized clinical trials. Ophthalmology. 2005;112:1177–85.
- Volstrup S, Henriken L, Paulson DB. Effect of acetazolamide on cerebral blood flow and cerebral metabolic rate oxigen. J Clin Invest. 1984;74:1634–9.
- Wang TH, Huang JY, Hung PT, et al. Ocular hypotensive effect and safety of brinzolamide ophthalmic solution in open angle glaucoma patients. J Formos Med Assoc. 2004;103:369–73.
- Zeyen TG, Caprioli J. Progression of disc and field damage in early glaucoma. Arch Ophthalmol. 1993;111:62–5.
- Zhao JC, Chen T. Brinzolamide induced reversible corneal decompensation. Br J Ophthalmol. 2005;89:389–90.
Стаття надійшла в редакцію 30.08.2017 р.
Рецензія на статтю надійшла в редакцію 11.09.2017 р.