- Автор: Super User
- Опубліковано: 14 липня 2019
- Перегляди: 4393
УДК 617.731–007.2+617.731–088.85+617.7–001.22+617.7–001.15+617.7–009+617.7–
073.178+6016–092.2
https://doi.org/10.30702/Ophthalmology.2019/09.094253
Мойсеєнко Н. М., канд. мед. наук, доцент кафедри оториноларингології та офтальмології з курсом хірургії голови і шиї
ДВНЗ «Івано-Франківський національний медичний університет», м. Івано-Франківськ, Україна
Резюме. Вивчали ультраструктурні зміни сітківки під дією лікування при травматичній оптичній невропатії, яку моделювали у 90 кролів. Тварин лікували за допомогою монотерапії метилпреднізолоном у дозі 30 мг/кг та по 15 мг/кг в комбінації з фосфен-стимуляцією із силою струму 800 мА на боці ураження і 300 мА на протилежному боці. За даними наших досліджень встановлено, що травматичне пошкодження орбітальної частини зорового нерва спричинює колікваційний некроз гангліонарних клітин і набряк шару нервових волокон сітківки. Проведене лікування з використанням монотерапії мегадоз кортикостероїдів призвело до часткового відновлення морфологічних параметрів іпсилатеральної сітківки. Комбіноване лікування із застосуванням фосфен-стимуляції характеризувалося зменшенням товщини сітківки, відновленням цитокаріометричних показників та регенераційними процесами в біполярних і гангліонарних нейронах. Отже, комплексне лікування травматичної оптичної невропатії із застосуванням фосфен-електростимуляції може бути альтернативою традиційному лікуванню, оскільки дає змогу зменшити дозу інфузій кортикостероїдів та забезпечує необхідний нейропротекторний ефект.
Ключові слова: травматична оптична невропатія, сітківка, нейропротекторна терапія, фосфен-електростимуляція.
ВСТУП
Травматична оптична невропатія (ТОН) є поліетіологічним захворюванням. Тактика лікування травматичних уражень зорового нерва суперечлива. Раніше прогноз при травматичній оптичній невропатії вважався невтішним. Згодом почали з’являлися непоодинокі повідомлення про успішне лікування, що спровокувало дискусію щодо доцільності лікування ТОН. За результатами Cook M. W. (1996) відновлення зорових функцій відбувається з кращими перспективами при застосуванні лікування, ніж без нього [1].
Як медикаментозну терапію переважно призначають високі дози кортикостероїдів [2]. Хоча ця точка зору є неоднозначною. Доведено, що застосування високих доз метилпреднізолону блокує вивільнення простагландинів, які потенціюють перекисне окиснення ліпідів, чим сприяють його відновленню [3].
У 2006 році Guy J. Ben Simon відзначив можливість пошкодження зорового нерва нейротоксинами, які секретуються гангліонарними клітинами сітківки в разі черепно-мозкової травми. Якщо пошкодження зорового нерва випереджає ураження інших частин нервової системи, то за рахунок автоімунної системи відбувається активація Т-клітинних медіаторів, що захищають і збільшують виживання гангліонарних клітин сітківки. Відомо, що попереднє ушкодження кори головного мозку індукує контралатеральне ушкодження зорового нерва. Виявлено мозковий нейротрофічний фактор, концентрація якого після ушкодження головного мозку збільшується в гангліонарних клітинах на боці ураження і зменшується на протилежному. Найвища концентрація цього фактора спостерігається протягом 1-ї доби з моменту травми, надалі його вміст зменшується до 11-ї доби, з новим підйомом уже після 21-ї доби. Це означає, що ушкодження головного мозку відбувається безперервно впродовж тривалого періоду, у той час як гангліонарні клітини виробляють власний захисний фактор, що забезпечує їх виживання. Відзначено, що протягом 2 тижнів при ізольованому травмуванні головного мозку самозахисні механізми сприяють виживанню гангліонарних клітин сітківки, що неможливе при поєднаному первинному травмуванні мозку і зорового нерва. Саме в таких випадках доведена ефективність застосування високих доз кортикостероїдів під час лікування ТОН, нейропротекторний ефект яких полягає в інгібуванні захисних нейротрофічних реакцій [4].
Наявність нейропротекторного мозкового фактора підтверджено подальшими дослідженнями при різних нейродегенеративних захворюваннях [5, 6]. Також зазначаються його властивості забезпечувати виживання гангліонарних клітин у разі гострої травми зорового нерва [7].
Неоднозначними є погляди стосовно дози кортикостероїдів. У початкових дослідженнях Anderson R. L. (1982) пропонував застосовувати дексаметазон по 3–5 мг/кг на день [8]. Згодом було прийнято внутрішньовенне введення дексаметазону в дозі 20 мг/кг протягом 6 год і метилпреднізолону 30 мг/кг, знижуючи дозу до 15 мг/кг кожні 6 год [9]. Пізніше Kitthaweesin K. Yospaiboon запропонував поєднання внутрішньовенного введення дексаметазону і метилпреднізолону і вважав, що така комбінація прискорює відновлення зорових функцій у пацієнтів із початково збереженими високими функціями [10]. Високі дози метилпреднізолону (по 500–2000 мг на добу) сприяють стабілізації мембран клітин і зменшують явища запалення, а мегадози (понад 4200 мг на добу) забезпечують нейропротекцію [11].
Однак опоненти подібного лікування стверджують, що кортикостероїди мають виражену токсичність, що пропорційно зростає у зв’язку з підвищенням дози інфузійного застосування [12]. Зазначається також, що високі дози і мегадози кортикостероїдів можуть бути шкідливими при пошкодженні центральної нервової системи, у тому числі і при ТОН. Тому їх використання багатьма вченими вважається недоцільним [11, 13].
Таким чином, з літературних даних можна дійти висновку, що застосування високих доз кортикостероїдів вважається стандартом лікування ТОН у багатьох країнах. Однак усе ще залишається багато запитань, пов’язаних із вираженими побічними діями такої терапії та неможливістю їх застосування саме в найоптимальніший термін (перші 48 год), коли стан пацієнта, як правило, обтяжений супутніми ураженнями. Саме це обумовлює необхідність пошуку нових методів лікування, які б сприяли збереженню нейропротекторних властивостей та зменшенню токсичних реакцій кортикостероїдів.
Наші попередні дослідження в експериментальних умовах підтвердили відновлення не тільки структури краніальної частини зорового нерва, а й покращення функціональної активності на прикладі зіничних реакцій на світло на тлі монотерапії високих доз кортикостероїдів після пошкодження його орбітальної частини [14]. Також показано, що при фосфен-електростимуляції (ФЕС) контралатеральної сторони, за рахунок ретино-гіпоталамічних зв’язків, змінюється архітектоніка супрахіазмального ядра гіпоталамусу, що, у свою чергу, призводить до збільшення продукції ендогенних кортикостероїдів [15]. Саме цей механізм, на нашу думку, міг би бути альтернативою в комплексному лікуванні ТОН. Зменшення інфузій кортикостероїдів знизило б їх токсичність, а стимуляція продукції ендогенних гормонів забезпечила б необхідний нейропротекторний ефект.
МЕТА ДОСЛІДЖЕННЯ
Вивчити зміни ультраструктури сітківки в разі ТОН при нейропротекторній терапії.
МАТЕРІАЛ ТА МЕТОДИ ДОСЛІДЖЕННЯ
Експериментальне дослідження виконано у 90 статевозрілих кролів породи шиншила, в яких моделювали травматичне пошкодження зорового нерва [9], згідно з висновком комісії з питань біоетики, ухваленого Івано-Франківським національним медичним університетом 2016 року.
Тварин були поділено на чотири групи, по 30 особин у кожній. У І групу ввійшли інтактні здорові кролі. У ІІ – кролі, яким виконано моделювання ТОН без лікування. Третя група після модельованої ТОН отримувала метилпреднізолон у дозі 30 мг/кг упродовж 3 днів, четверта – метилпреднізолон по 15 мг/кг упродовж 5 днів з комбінацією з 3-ї доби ФЕС із силою струму 800 мА на боці ураження і 300 мА на протилежному боці.
Морфологічний аналіз сітківки піддослідних тварин усіх груп після виведення з експерименту (декапітація) проведено в електронно-мікроскопічній лабораторії кафедри анатомії людини Івано-Франківського національного медичного університету через 2 тижні після травми.
Використали гістологічний (забарвлення гематоксиліном та еозином) та електронно-мікроскопічний методи дослідження.
Для гістологічного дослідження шматочки сітківки фіксували в 10 % нейтральному формаліні протягом 2 тижнів із триразовою зміною фіксуючого розчину. Через 2 тижні, після попереднього промивання під проточною водою з наступним зневодненням у батареї спиртів зростаючої концентрації, проводили виготовлення парафінових блоків за загальноприйнятою методикою. На санному мікротомі отримували серійні зрізи, які забарвлювали гематоксиліном та еозином.
Для морфометричних досліджень використовували фотографії гістологічних зрізів, забарвлених гематоксиліном та еозином (поле зору світлового мікроскопа Leiсa DM750 фотографували за допомогою цифрової ССD-камери (Industrial digital camera UHCCD05100KPA-U-NA-N-C-SQ-NA) із розширенням 1200 × 1600) і збережених у форматі tif. Морфометрію здійснювали за допомогою програми ImageJ версії 1.47t, яка розроблена співробітниками National Institutes of Health (USA) (Schneider, 2012) і розповсюджується з відкритим вихідним кодом без ліцензійних обмежень.
Проводили вимірювання товщини різних шарів сітківки, а також визначали площу гангліонарних нейронів, їх ядер та ядерно-цитоплазматичний індекс (ЯЦІ). Компʼютерне опрацювання даних здійснювали за допомогою статистичного пакету Stat.Soft.Inc; Tulsa, OK, USA; Statistica 6.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
На 14-у добу після травматичного пошкодження очноямкової частини правого зорового нерва в сітківці правого очного яблука ІІ групи тварин відзначається достовірне потовщення сітківки порівняно із контрольною групою з 178,50 ± 11,47 до 246,85 ± 23,69 мкм унаслідок збільшення товщини фотосенсорного шару (ФСШ) на 70,8 %, зовнішнього ядерного шару (ЗЯШ) на 54,9 %, внутрішнього ядерного шару (ВЯШ) на 40,1 %, шару гангліонарних клітин (ГШ) на 53 % та шару нервових волокон (ШНВ) на 35 % (таблиця 1).
Таблиця 1. Морфометричні показники шарів сітківки при ТОН (M ± m, мкм)
| Шари сітківки | Групи тварин | |
|
І група |
ІІ група |
|
| ФСШ |
32,43 ± 4,85 |
55,41 ± 13,64 |
| ЗЯШ |
33,14 ± 4,08 |
51,33 ± 8,52 |
| ЗСШ |
10,43 ± 2,72 |
11,35 ± 3,06 |
| ВЯШ | 27,52 ± 7,92 | 38,57 ± 4,16 ↑40,1 %* |
| ВСШ | 38,61 ± 7,46 | 37,51 ± 5,83 |
| ГШ | 20,02 ± 3,61 | 30,61 ± 11,64 ↑53 %* |
| ШНВ | 16,36 ± 4,72 | 22,08 ± 4,35 ↑35 %* |
Примітка. *Вірогідна різниця з І групою р < 0,05. ЗСШ – зовнішній сітчастий шар; ВСШ – внутрішній сітчастий шар.
Також у тварин ІІ групи простежується набряк ВЯШ, ЗЯШ і ГШ (рисунок 1, б) і переміщення ядр із ВЯШ у ЗСШ. У ГШ спостерігалась мікрокістозна дегенерація гангліонарних нейронів та перицелюлярний набряк. Привертає увагу значне зменшення чисельності мультиполярних нейронів у ГШ (рисунок 1, б, в) порівняно з інтактною групою тварин (рисунок 1, а). Площа цих нейронів зростає порівняно з інтактними з 58,81 ± 9,01 до 71,68 ± 8,87 мкм2 (р < 0,01), натомість площа ядра достовірно не змінюється і становить 37,06 ± 36,20 мкм2 (інтактна група – 36,20 ± 6,63 мкм2), що призводить до зменшення ЯЦІ з 1,14 ± 0,36 до 1,14 ± 0,36 (р < 0,03). Виявляють значне потовщення та просвітлення нервових волокон ШНВ (рисунок 1, б, в).
На ультраструктурному рівні у ВЯШ спостерігалися нейрони як з дистрофічно-деструктивними змінами, так і звичайної будови (рисунок 2, а). У перших простежується каріопікноз, значні інвагінації ядерної оболонки, просвітлення та вакуолізація цитоплазми. Також виявляли поодинокі нейрони в стані колікваційного некрозу.
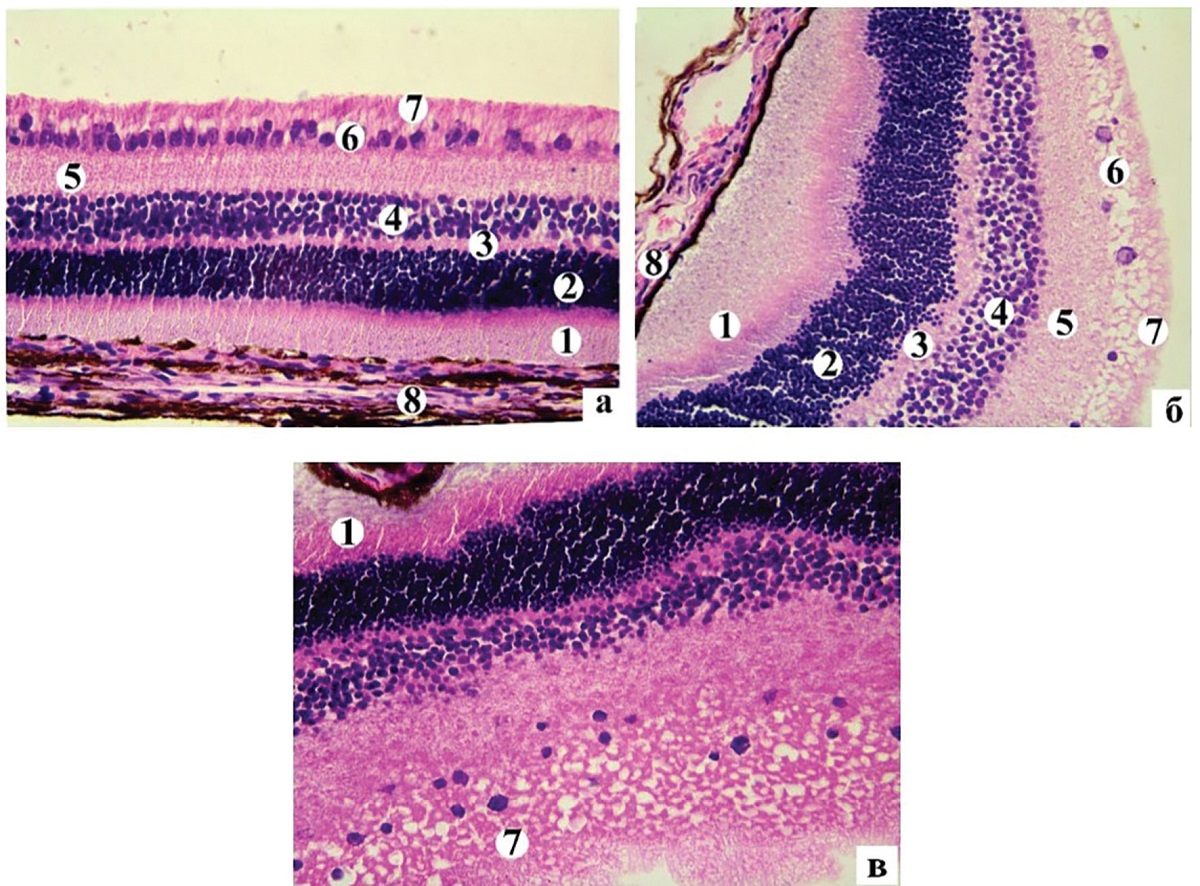 Рисунок 1. Гістоструктура правої сітківки І групи (а) та її набряк у ІІ групи (б, в) кролів на 14-у добу експерименту: 1 – ФСШ; 2 – ЗЯШ; 3 – ЗСШ; 4 – ВЯШ; 5 – ВСШ; 6 – ГШ; 7 – ШНВ; 8 – пігментний шар. Забарвлення гематоксиліном та еозином. Мікро- фотографії, ×400
Рисунок 1. Гістоструктура правої сітківки І групи (а) та її набряк у ІІ групи (б, в) кролів на 14-у добу експерименту: 1 – ФСШ; 2 – ЗЯШ; 3 – ЗСШ; 4 – ВЯШ; 5 – ВСШ; 6 – ГШ; 7 – ШНВ; 8 – пігментний шар. Забарвлення гематоксиліном та еозином. Мікро- фотографії, ×400
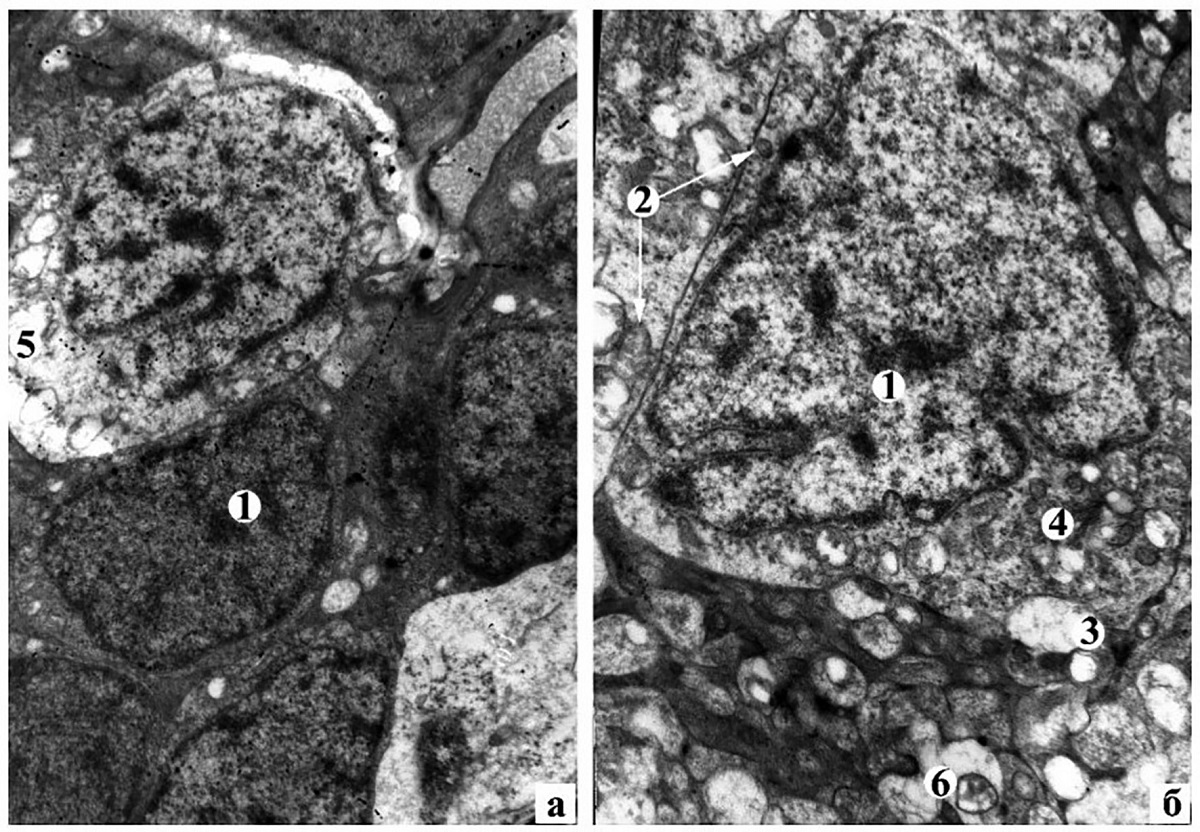
Рисунок 2. Дистрофічно-деструктивні зміни біполярних (а) та гангліонарних нейронів (б) ІІ групи тварин на 14-у добу експерименту: 1 – ядро нейрона; 2 – мітохондрії; 3 – вакуолі; 4 – гранулярна ендоплазматична сітка; 5 – колікваційний некроз нейрона; 6 – просвітлення аксоплазми в шарі нервових волокон. Електронні мікрофотографії: а – ×4800; б – ×6400
У ГШ переважна більшість нейронів має помірної електронно-оптичної щільності цитоплазму з дрібними вакуолями (рисунок 2, б). Ядра набувають трикутної та неправильної форми внаслідок значних інвагінацій ядерної оболонки, що вказує на реактивні зміни в клітині. Цистерни гранулярної ендоплазматичної сітки розширені, частина з них зруйновані, інші – вкорочені, містять поодинокі прикріплені рибосоми. Одна частина мітохондрій у клітині має звичайну ультраструктурну організацію, друга – частково дезорганізовані кристи, третя частина – зі зруйнованою внутрішньою мембраною. У ШНВ виявлено капіляри зі значним набряком ендотеліоцитів, які перекривали просвіт судини. Навколо таких капілярів простежувався периваскулярний набряк. У частині нервових волокон ШНВ відзначалась аксональна дегенерація, що морфологічно проявлялась електронно прозорою аксоплазмою, зменшенням кількості нейрофіламентів на тлі повної відсутності мікротрубочок, дезорганізацією і руйнуванням мітохондріальних крист. Проведене лікування впродовж 14 діб у тварин ІІІ і ІV групи, порівняно з ІІ групою, призвело до достовірного зменшення товщини сітківки, у ІІІ групі до 216,74 ± 20,14 мкм, у ІV – до 203,82 ± 18,49 мкм. Однак такі показники залишилися достовірно більшими за інтактну групу тварин. На світлооптичному рівні відзначається зменшення набряку в різних шарах сітківки та відновлення її гістоструктури(рисунок 3). У ГШ сітківки ІІІ групи тварин чисельність нейронів є незначною і вони малих розмірів, тоді як у ІV групі гангліонарні нейрони за розмірами, щільністю і розташуванням наближаються до інтактної сітківки (рисунок 3, а, б). Якісні дані підтверджуються і морфометричними показниками. Так, у ІІІ групі площа гангліонарних нейронів, їх ядер і ЯЦІ є достовірно менші від І і ІІ груп тварин і становлять відповідно 39,42 ± 6,15 мкм2, 20,97 ± 6,38 мкм2, 1,22 ± 0,44. У ІV групі площа гангліонарних нейронів, їх ядер і ЯЦІ є меншими від ІІ групи і становлять відповідно 60,03 ± 11,7 мкм2 (р < 0,01), 36,33 ± 8,69 мкм2 (р < 0,01), 1,70 ± 0,79 (р > 0,05). Такі кількісні показники гангліонарних нейронів ІV групи кролів достовірно не відрізняються від інтактних тварин (у всіх випадках р > 0,05).
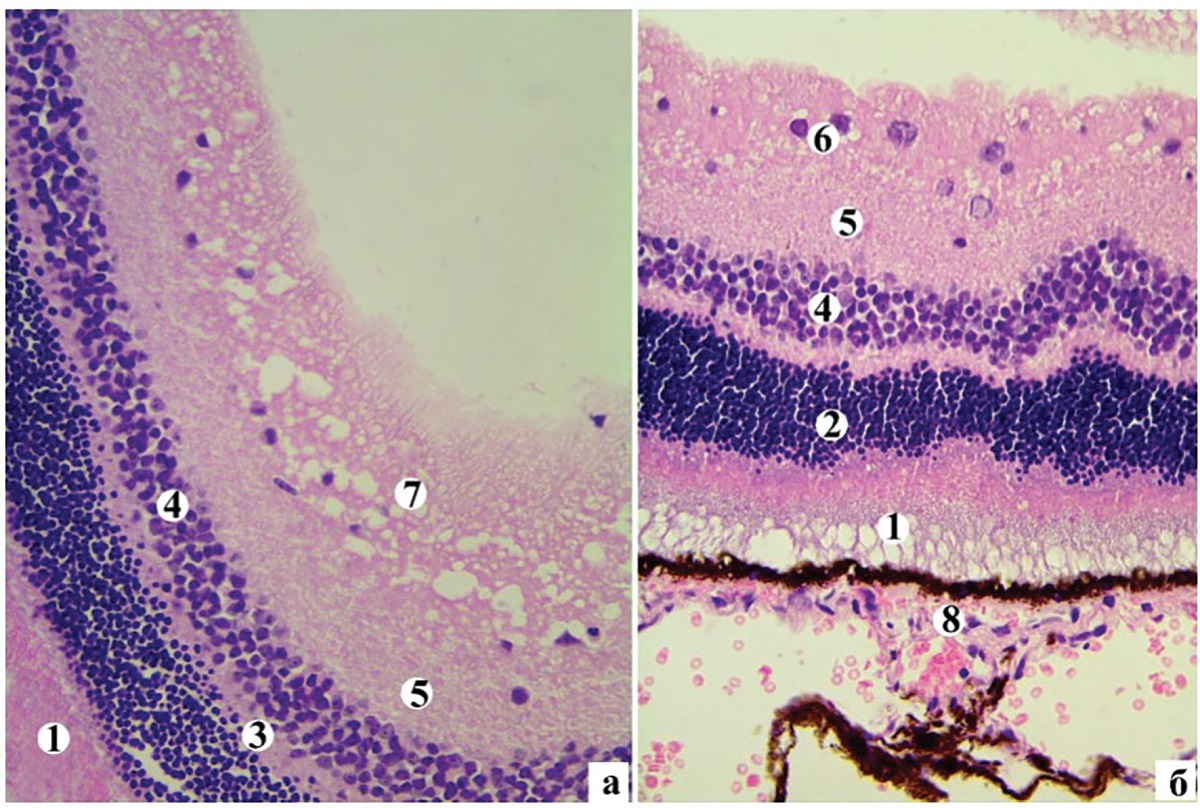
Рисунок 3. Гістоструктура правої сітківки ІІІ групи (а) та ІV групи (б) кролів на 14-у добу лікування: 1 – ФСШ; 2 – ЗЯШ; 3 – ЗСШ; 4 – ВЯШ; 5 – ВСШ; 6 – ГШ; 7 – ШНВ; 8 – пігментний шар. Забарвлення гематоксиліном та еозином. Мікрофотографії, ×400
За даними морфометричного аналізу в ІІІ і ІV групі відзначалося достовірне зменшення, порівняно з ІІ групою, товщини ФСШ, ЗЯШ, ВЯШ, ГШ, але ці показники залишалися достовірно більшими за інтактну групу тварин, за винятком ГШ ІV групи (таблиця 2). Щодо ШНВ, то в ІІІ групі товщина його достовірно не змінюється, порівняно з ІІ групою тварин, трапляються мікрокісти (рисунок 3, а), натомість у ІV групі товщина достовірно зменшується, проте залишається вищою за інтактні показники (таблиця 2, рисунок 3, б).
Таблиця 2. Морфометричні показники сітківки після лікування (M ± m, мкм)
| Шари сітківки |
Групи тварин | |||
|
І |
ІІ | ІІІ |
ІV |
|
| ФСШ |
32,43 ± 4,85 |
55,41 ± 13,64↑* | 45,36 ± 8,56 |
40,54 ± 7,96 |
| ЗЯШ |
33,14 ± 4,08 |
51,33 ± 8,52↑* | 40,26 ± 4,98 |
41,56 ± 6,84 |
| ЗСШ |
10,43 ± 2,72 |
11,35 ± 3,06 | 10,58 ± 3,78 |
10,75 ± 2,65 |
| ВЯШ |
27,52 ± 7,92 |
38,57 ± 4,16↑* | 33,75 ± 4,21 |
30,24 ± 3,52 |
| ВСШ |
38,61 ± 7,46 |
37,51 ± 5,83 | 38,56 ± 6,75 |
36,25 ± 5,21 |
| ГШ | 20,02 ± 3,61 | 30,61 ± 11,64↑* | 25,34 ± 4,75 | 24,32 ± 5,11↓** |
| ШНВ | 16,36 ± 4,72 | 22,08 ± 4,35↑* | 22,89 ± 5,12 | 20,16 ± 4,87 |
Примітка. *Вірогідна різниця з І групою p < 0,05; **вірогідна різниця з ІІ групою.
У тварин після лікування на ультраструктурному рівні простежуються відновно-регенераційні процеси в сітківці правого ока. У нейронах ВЯШ спостерігаються просвітлення нейроплазми окремих перикаріонів, дезорганізація крист мітохондрій. У ГШ ІІІ групи тварин більшість нейронів перебуває в стані вакуольної дистрофії, в окремих спостерігаються явища апоптозу (рисунок 4, а).
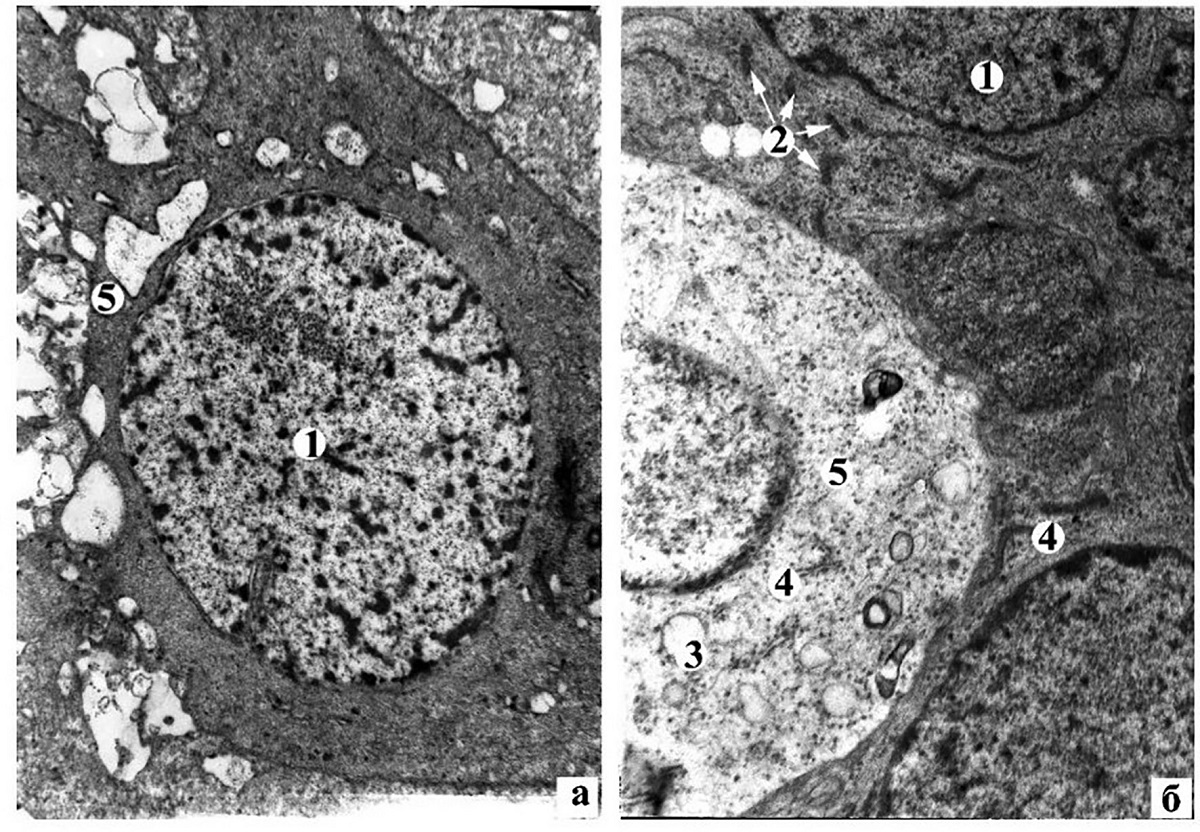
Рисунок 4. Дистрофічно-деструктивні зміни гангліонарних нейронів ІІІ групи (а) та відновні процеси в гангліонарних нейронах ІV групи (б) кролів через 2 тижні лікування: 1 – ядро нейрона; 2 – молоді мітохондрії; 3 – вакуолі; 4 – гранулярна ендоплазматична сітка; 5 – вакуольна дистрофія нейрона. Електронні мікрофотографії: а – ×4800; б – ×6400
У гангліонарних нейронах ІV групи спостерігаються компенсаторно-регенераційні процеси, що характеризуються: гіпертрофією цистерн гранулярної ендоплазматичної сітки та збільшенням на її поверхні прикріплених рибосом; відновленням дрібнозернистої нейроплазми помірної електронної щільності; появою в перикаріоні молодих електронно-щільних мітохондрій щільно упакованими кристами (рисунок 4, б). Ядра гангліонарних нейронів мають округлу форму з дифузно розташованими гранулами еухроматину. Виявляються окремі гангліонарні нейрони з явищами вакуольної дистрофії. У ШНВ спостерігаються аксони звичайної будови та з просвітленою аксоплазмою та вакуолями. При цьому слід зазначити, що в ІІІ групі тварин у ШНВ більшість нервових волокон перебувають у стані аксональної дегенерації.
Таким чином, у сітківці ока після травматичного пошкодження очноямкової частини правого зорового нерва спостерігаються дистрофічно-деструктивні зміни, переважно в нейронах ВЯШ та ГШ, нервових волокнах ШНВ. Зміни в гангліонарних нейронах мають реактивний характер унаслідок аксональної реакції, тоді як у біполярних нейронах переважає вакуольна дистрофія через порушення кровопостачання сітківки.
ВИСНОВКИ
Проведене лікування в ІІІ групі кролів (монотерапія мегадоз кортикостероїдів) сприяло частковому відновленню морфологічних параметрів правої сітківки.
Найбільш оптимальним є лікування із застосуванням ФЕС, що, за даними наших досліджень, призводить до компенсаторно-регенераційних процесів, описаних також у роботах інших дослідників [16–19], які характеризуються зменшенням товщини сітківки, відновленням цитокаріометричних показників та регенераційними процесами в біполярних і гангліонарних нейронах.
Отже, комплексне лікування ТОН із використанням ФЕС може бути альтернативою традиційному лікуванню, оскільки дає змогу зменшити дозу інфузій кортикостероїдів та забезпечує необхідний нейропротекторний ефект.
Мойсеенко Н. Н., канд. мед. наук, доцент кафедры оториноларингологии и офтальмологии с курсом хирургии головы и шеи
ДВНЗ «Ивано-Франковский национальный медицинский университет», г. Ивано-Франковск, Украина
УЛЬТРАСТРУКТУРНЫЕ АСПЕКТЫ НЕЙРОПРОТЕКТОРНОЙ ТЕРАПИИ ПРИ ТРАВМАТИЧЕСКОЙ ОПТИЧЕСКОЙ НЕВРОПАТИИ
Резюме. Изучали ультраструктурные изменения сетчатки под действием лечения при травматической оптической невропатии, которую моделировали у 90 кроликов. Животных лечили с помощью монотерапии метилпреднизолоном в дозе 30 мг/кг и по 15 мг/кг в комбинации с фосфен-стимуляцией с силой тока 800 мА на стороне поражения и 300 мА на противоположной стороне. По данным наших исследований установлено, что травматическое повреждение орбитальной части зрительного нерва вызывает колликвационный некроз ганглионарных клеток и отек слоя нервных волокон сетчатки. Проведенное лечение с использованием монотерапии мегадоз кортикостероидов привело к частичному восстановлению морфологических параметров ипсилатеральной сетчатки. Комбинированное лечение с применением фосфен-стимуляции характеризовалось уменьшением толщины сетчатки, восстановлением цитокариометрических показателей и регенерационными процессами в биполярных и ганглионарных нейронах. Таким образом, комплексное лечение травматической оптической невропатии с использованием фосфен-электростимуляции может быть альтернативой традиционному лечению, так как позволяет уменьшить дозу инфузий кортикостероидов и обеспечивает необходимый нейропротекторный эффект.
Ключевые слова: травматическая оптическая невропатия, сетчатка, нейропротекторная терапия, фосфен-электростимуляция.
Moyseyenko N. M., Candidate of Medical Science, Reader of the Department of Otorhinolaryngology and Ophthalmology – Head and Neck Surgery
Ivano-Frankivsk National Medical University, Ivano-Frankivsk, Ukraine
ULTRASTRUCTURAL ASPECTS OF NEUROPROTECTIVE THERAPY OF TRAUMATIC OPTICAL NEUROPATHY
Abstract. Ultrastructural changes in the retina during traumatic optic neuropathy (TON) treatment were studied. Our previous studies experimentally confirmed that after the damage to the orbital part of the optic nerve, within the background of highdose corticosteroid monotherapy, not only the structure of the cranial part of the optic nerve restores, but also its functional activity improves, by the example of zoonotic reactions to light. It was detected that phosphene electrostimulation (PES) of the contralateral side, due to retino-hypothalamic bonds, changes the architectonic nature of the suprachioscular nucleus of the hypothalamus, which, in turn, leads to the increase in the production of endogenous corticosteroids. In our opinion, this mechanism could be an alternative to the comprehensive treatment of TON. Decrease in the doses of corticosteroid infusions would reduce their toxicity, stimulate production of endogenous hormones and provide the necessary neuroprotective effect.
The purpose of the study was to investigate the changes in the retinal ultrastructure in traumatic optical neuropathy in response to neuroprotective therapy.
Methods. Ninety rabbits were treated with methylprednisolone 30 mg/kg only or with methylprednisolone 15 mg/kg in combination with phosphene stimulation with a current strength of 800 mA on the side of the lesion and 300 mA contralaterally.
Results. According to our research, traumatic damage to the orbital part of the optic nerve causes colliquative necrosis of ganglion cells and retinal nerve fibre layer oedema. Corticosteroid megadose monotherapy has resulted in a partial restoration of morphological parameters of the ipsilateral retina. Combination therapy with phosphene electrostimulation was characterized by the decrease in the retinal thickness, reduction of cytokaryometric indices and regeneration processes in bipolar and ganglionic neurons.
Conclusion. Thus, combination therapy of TON with the use of phosphene electrostimulation may be an alternative to conventional treatment, since it allows reducing the dose of corticosteroid infusions and provides the necessary neuroprotective effect.
Keywords: traumatic optical neuropathy, retina, neuroprotective therapy, phosphene electrostimulation.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
REFERENCES
1. Cook MW, Levin LA, Joseph MP, Pinczower EF. Traumatic optic neuropathy. A metaanalysis. Arch Otolaryngol Head Neck Surg. 1996 Apr;122(4):389–92.
2. Levin LA, Beck RW, Joseph MP, Seiff S, Kraker R. The treatment of traumatic optic neuropathy: the International Optic Nerve Trauma Study. Ophthalmology. 1999 Jul;106(7): 1268–77.
3. Liu D, Li L, Augustus L. Prostaglandin release by spinal cord injury mediates production of hydroxyl radical, malondialdehyde and cell death: a site of the neuroprotective action of methylprednisolone. J Neurochem. 2001 May;77(4):1036–47.
4. Ben Simon GJ, Hovda DA, Harris NG, Gomez-Pinilla F, Goldberg RA. Traumatic brain injury induced neuroprotection of retinal ganglion cells to optic nerve crush. J Neurotrauma. 2006 Jul;23(7):1072–82.
5. Bikbova G, Oshitari T, Baba T, Yamamoto S. Neurotrophic factors for retinal ganglion cell neuropathy - with a special reference to diabetic neuropathy in the retina. Curr Diabetes Rev. 2014 May;10(3):166–76.
6. Weber AJ, Harman CD, Viswanathan S. Effects of optic nerve injury, glaucoma, and neuroprotection on the survival, structure, and function of ganglion cells in the mammalian retina. J Physiol. 2008 Sep;586(18):4393–400. https://doi.org/10.1113/jphysiol.2008
7. Feng L, Puyang Z, Chen H, Liang P, Troy JB, Liu X. Overexpression of Brain-Derived Neurotrophic Factor Protects Large Retinal Ganglion Cells After Optic Nerve Crush in Mice. eNeuro. 2017 Jan 17;4(1):ENEURO.0331-16.2016. https://doi.org/10.1523/ENEURO.0331-16.2016
8. Anderson RL, Panje WR, Gross CE. Optic nerve blindness following blunt forehead trauma. Ophthalmology. 1982 May;89(5):445–55.
9. Spoor TC, Hartel WC, Lensink DB, Wilkinson MJ. Treatment of traumatic optic neuropathy with corticosteroids-correction. Am J Ophthalmol. 1991 Apr;111(4):526.
10. Kitthaweesin K, Yospaiboon Y. Dexamethasone and methylprednisolone in treatment of indirect traumatic optic neuropathy. J Med Assoc Thai. 2001 May;84(5):628–34.
11. Alderson P, Roberts I. Corticosteroids for acute traumatic brain injury. Cochrane Database Syst Rev. 2005 Jan 25;(1):CD000196.
12. Liu D, Li L, Augustus L. Prostaglandin release by spinal cord injury mediates production of hydroxyl radical, malondialdehyde and cell death: a site of the neuroprotective action of methylprednisolone. J Neurochem. 2001 May;77(4):1036–47.
13. Roberts I, Yates D, Sandercock P, Farrell B, Wasserberg J, Lomas G, et al. Effect of intravenous corticosteroids on death within 14 days in 10008 adults with clinically significant head injury (MRC CRASH trial): randomised placebo-controlled trial. Lancet. 2004 Oct;364 (9442):1321–8. https://doi.org/10.1016/S0140-6736(04)17188-2
14. Moyseyenko N. [Activation of regenerative processes optic nerve in traumatic injury under high doses of corticosteroids]. Ukrainian Neurosurgical Journal. 2016;1:40–3. (in Ukrainian). https://doi.org/10.25305/unj.61883
15. Moyseyenko NN. The role of neurohumoral dysfunction in pathogenesis of the traumatic optic neuropathy. World Of Medicine And Biology. 2017;3(61):138–42. https://doi.org/10.26724/2079-8334-2017-3-61-138-142
16. Fischer D, Harvey AR, Pernet V, Lemmon VP, Park KK. Optic nerve regeneration in mammals: Regenerated or spared axons? Exp Neurol. 2017 Oct;296:83–88. https://doi.org/10.1016/j.expneurol.2017.07.008
17. Benowitz LI, He Z, Goldberg J. Reaching the brain: Advances in optic nerve regeneration. Exp Neurol. 2017 Jan;287(Pt 3):365–73. https://doi.org/10.1016/j.expneurol.2015.12.015
18. Fischer D, Leibinger M. Promoting optic nerve regeneration. Prog Retin Eye Res. 2012 Nov;31(6):688–701.
19. Sánchez-Migallón MC, Valiente-Soriano FJ, Salinas-Navarro M, Nadal-Nicolás FM, Jiménez-López M, Vidal-Sanz M. Nerve fibre layer degeneration and retinal ganglion cell loss long term after optic nerve crush or transection in adult mice. Exp Eye Res. 2018 May;170: 40–50. https://doi.org/10.1016/j.exer.2018.02.010
Стаття надійшла в редакцію 29.10.2018 р.
Рецензія на статтю надійшла в редакцію 13.11.2018 р.