- Автор: Карлійчук М. А., Бездітко П. А., Пінчук С. В.
- Категорія: Український журнал «Офтальмологія» № 2 (13) 2021
- Опубліковано: 30 червня 2021
- Перегляди: 3658
https://doi.org/10.30702/Ophthalmology30062021-13.2.14-23/833-007.17
УДК 617.736-007.7:616.379-008.64:616.833-007.17
Карлійчук М. А.1, д-р мед. наук, доцент кафедри офтальмології ім. Б. Л. Радзіховського
Бездітко П. А.2, д-р мед. наук, професор, завідувач кафедри офтальмології, https://orcid.org/0000-0002-9466-9586
Пінчук С. В.3, канд. мед. наук, лікар-офтальмолог
1Буковинський державний медичний університет, м. Чернівці, Україна
2Харківський національний медичний університет, м. Харків, Україна
3«Центр мікрохірургії ока «Ваш Зір», м. Чернівці, Україна
Резюме. Робота присвячена вивченню особливостей змін морфометричних параметрів центральної зони сітківки залежно від ступеня тяжкості діабетичної полінейропатії (ДПН) у 575 хворих на цукровий діабет (ЦД) 2-го типу (1150 очей). У 63,5 % хворих на ЦД (365 осіб) діагноз ДПН був виключений (N0 стадія). Діабетична полінейропатія була діагностована у 36,5 % хворих на ЦД (210 осіб). Асимптоматична ДПН відзначалась у 17,5 % хворих на ЦД (101 особа): N1А стадія – у 8,1 % хворих (47 осіб), N1В стадія – у 9,4 % хворих (54 особи); симптоматична ДПН – у 15,5 % хворих на ЦД (89 осіб); N2А стадія – у 8,0 % хворих (46 осіб), N2В стадія – у 7,5 % хворих (43 особи); стадія тяжких ускладнень (N3 стадія) – у 3,5 % хворих на ЦД (20 осіб). Контрольну групу становили 50 здорових осіб (100 очей). Крім стандартних, методи офтальмологічного дослідження включали оптичну когерентну томографію сітківки та зорового нерва. У хворих на ЦД 2-го типу встановлено морфометричні особливості ураження макули залежно від тяжкості ДПН: індекс фокальної втрати об’єму (FLV) гангліонарних клітин сітківки при асимптоматичній А ДПН у 8,4 раза, при асимптоматичній В ДПН – у 8,7 раза, при симптоматичній А ДПН – у 14,1 раза, при симптоматичній В ДПН – у 14,3 раза, при стадії тяжких ускладнень ДПН – у 15,3 раза (р < 0,05) перевищував показники здорових осіб відповідного віку. Товщина сітківки у фовеолярній зоні хворих з асимптоматичною А ДПН на 9,1 %, асимптоматичною В ДПН – на 8,9 %, при стадії тяжких ускладнень ДПН – на 12,7 % була меншою від показників здорових осіб відповідного віку. Виявлені морфометричні особливості макули при ЦД 2-го типу можуть слугувати неінвазивним офтальмологічним біомаркером ступеня тяжкості ДПН.
Ключові слова: макула, оптична когерентна томографія, діабетична полінейропатія, ступінь тяжкості.
У всьому світі відзначається стрімке зростання хворих на цукровий діабет (ЦД). Діабетична полінейропатія (ДПН) є одним із найчастіших ускладнень ЦД, на яке страждають до 1/4 всіх хворих на ЦД, а у безсимптомній формі вона наявна у всіх хворих [3, 7]. Через мінливу клінічну картину ДПН її діагностика є нелегким завданням. Одним із аспектів проблеми діагностики ДПН є раннє виявлення ознак ураження периферичної нервової системи у хворих із ЦД за допомогою ефективних та неінвазивних методів [1, 3–5]. Деякі дослідники вказують на те, що низка змін сітківки, зорового нерва, нервових волокон рогівки та зорових функцій може корелювати з ДПН, тому їх оцінювання може дати додаткову інформацію про виявлення та визначення ступеня її тяжкості [5, 9, 15, 17]. Відомо, що оптична когерентна томографія (ОКТ) дозволяє отримати найбільш повний і точний кількісний аналіз структури сітківки на різних рівнях [2, 3]. Клінічно за допомогою ОКТ у хворих на ЦД було виявлено раннє стоншення шару нервових волокон, гангліонарного шару та інших шарів сітківки, що відбувалося ще до появи ознак діабетичної ретинопатії [8, 10, 13]. Таким чином, логічним здається припущення, що зміни морфометричних параметрів сітківки хворих із ЦД 2-го типу можуть свідчити про ступінь тяжкості ДПН.
Мета роботи – визначити особливості змін морфометричних параметрів центральної зони сітківки залежно від ступеня тяжкості діабетичної полінейропатії.
Матеріали та методи
Аналіз морфометричних параметрів сітківки здійснювали на основі даних обстеження 575 хворих (1150 очей) на ЦД 2-го типу віком від 44 до 69 років (у середньому 55,9 ± 7,8 року). Тривалість ЦД до 5 років відзначалася у більшості хворих (71,8 %, 413 осіб), від 5 до 10 років – у 16,2 % хворих (93 особи), понад 10 років – у 12,0 % хворих (69 осіб).
Критерії включення: хворі (чоловіки або жінки) на ЦД 2-го типу; підписана інформована згода; показник тонометричного тиску (Ро) не більше 21 мм рт. ст.; еметропія, гіперметропія або міопія слабкого ступеня; відсутність катаракти або наявність початкової вікової катаракти; відсутність очних хірургічних втручань в анамнезі, у тому числі лазерних.
Критерії виключення: гіперметропія або міопія середнього та високого ступеня; діабетичний макулярний набряк, відшарування сітківки, помутніння оптичних середовищ, які обтяжують виконання ОКТ; стани, які можуть вплинути на ефективність та безпеку виконання офтальмологічних досліджень (офтальмогерпес, кератит, увеїт, ретинальний васкуліт, ретинальна ангіоматозна проліферація); глаукома, оптичні нейропатії іншого генезу (токсична, інфекційна тощо); атрофії зорового нерва іншого генезу (вроджені, токсичні, травматичні тощо); дегенеративні захворювання сітківки (вікова макулярна дегенерація, спадкові дегенерації сітківки); нейродегенеративні захворювання головного мозку, які можуть впливати на результати досліджень (хвороба Альцгеймера, хвороба Паркінсона, латеральний аміотрофічний склероз).
Відповідно до класифікації ДПН з урахуванням тяжкості (Міжнародне керівництво з амбулаторного ведення ДПН, 1995) [6], у 63,5 % хворих (365 осіб) на ЦД діагноз ДПН був виключений (N0 стадія). Діабетична полінейропатія була діагностована у 36,5 % хворих на ЦД (210 осіб). Асимптоматична ДПН відзначалась у 17,5 % хворих на ЦД (101 особа): N1А стадія – у 8,1 % хворих (47 осіб), N1В стадія – у 9,4 % хворих (54 особи); симптоматична ДПН – у 15,5 % хворих на ЦД (89 осіб); N2А стадія – у 8,0 % хворих (46 осіб), N2В стадія – у 7,5 % хворих (43 особи); стадія тяжких ускладнень (N3 стадія) – у 3,5 % хворих на ЦД (20 осіб). Контрольну групу становили 50 здорових осіб (100 очей).
Крім стандартних (візометрії, тонометрії, дослідження очного дна), методи офтальмологічного дослідження включали ОКТ сітківки та зорового нерва. Для спектральної ОКТ використовували RTVue-100 (Optovue, США) з роздільною здатністю 5 мікрон. Аналіз комплексу гангліонарних клітин сітківки (ГКС) проводили в макулярній ділянці діаметром 6 × 6 мм з центром 1 мм темпорально від фовеоли, що відповідає 20º на мапі поля зору (10º – у верхньому та нижньому напрямку, 7º – у назальному, 13º – у темпоральному напрямках). Під час дослідження комплексу ГКС проаналізовано 5 показників: середня товщина, середня товщина у верхньому та в нижньому сегментах, індекс фокальної втрати об’єму (Focal loss volume (FLV)) та індекс глобальної втрати об’єму (Global loss volume (GLV)). Вимірювали товщину сітківки у фовеолі, пара- й перимакулярно, з діаметром дослідження 1, 3 та 5 мм відповідно.
Статистичну обробку матеріалу здійснювали з використанням методів варіаційної статистики за допомогою програмного комп’ютерного забезпечення Microsoft Excel 2000. Розраховували середню арифметичну величину (M), стандартне відхилення (σ), стандартну похибку середнього (m), коефіцієнт варіації (Сν), показник достовірності відмінності (p), 95 % довірчий інтервал (ДІ). У роботі прийнятий критерій значущої відмінності p < 0,05.
Результати та їх обговорення
Аналізуючи показник товщини сітківки у фовеолярній зоні у хворих з ДПН, виявили залежність від тяжкості захворювання (таблиця 1).
Середній показник товщини сітківки у фовеолярній ділянці у хворих з асимптоматичною А ДПН був на 9,1 %, асимптоматичною В ДПН – на 8,9 %, при стадії тяжких ускладнень ДПН – на 12,7 % менше відповідного показника у контрольній групі (263,9 ± 25,9 мкм) (р < 0,05). Найнижчий середній показник товщини сітківки у фовеолярній зоні відзначили у хворих у стадії тяжких ускладнень ДПН. При симптоматичній А ДПН цей показник на 17,0 %, симптоматичній В ДПН – на 14,1 % (р < 0,001), у хворих на ЦД без ДПН – на 11,0 % (р < 0,05) перевищував відповідний при стадії тяжких ускладнень ДПН.
| Групи | Показники | Фовеолярна, мкм | Середня, мкм | ||
| Контроль, n=100 очей | M±m | 263,9±25,9' | 321,3±13,0 | ||
| Коливання | 228,8–302,6 | 299,3–346,0 | |||
| 95% ДІ | 256,6–270,4 | 317,5–326,0 | |||
| N0 стадія, n=730 очей | M±m | 255,9±25,3' | 319,6±13,7 | ||
| Коливання | 204,3–321,4 | 295,7–347,8 | |||
| 95% ДІ | 248,3–262,2 | 214,2–224,3 | |||
| N1A стадія, n=94 ока | M±m | 239,8±25,5* | 316,6±15,5 | ||
| Коливання | 192,4–290,6 | 284,3–345,3 | |||
| 95% ДІ | 227,5–250,8 | 211,3–221,2 | |||
| N1B стадія, n=108 очей | M±m | 240,4±27,9* | 320,5±25,6 | ||
| Коливання | 187,7–301,9 | 283,4–376,3 | |||
| 95% ДІ | 225,1–249,8 | 305,3–334,9 | |||
| N2A стадія, n=92 ока | M±m | 269,6±38,3' | 327,0±30,4 | ||
| Коливання | 234,7–362,6 | 271,9–369,3 | |||
| 95% ДІ | 250,4–291,5 | 218,2–245,9 | |||
| N2B стадія, n=86 очей | M±m | 262,9±40,1' | 326,2±31,2 | ||
| Коливання | 219,5–386,2 | 269,3–348,8 | |||
| 95% ДІ | 250,4–291,5 | 205,7–243,7 | |||
| N3 стадія, n=40 очей | M±m | 230,5±41,6* | 314,8±32,4 | ||
| Коливання | 182,6–358,7 | 251,7–401,1 | |||
| 95% ДІ | 209,7–250,4 | 299,7–330,3 | |||
| Примітка. * – достовірна відмінність між середнім значенням показника в досліджуваній і контрольній групах; ' – достовірна відмінність між середнім значенням показника у досліджуваній групі та групі хворих у N3 стадії ДПН. | |||||
Аналізуючи показник середньої товщини парамакулярної ділянки сітківки, у хворих з ДПН не виявили залежності від тяжкості захворювання (таблиця 2).
Середній показник середньої товщини парамакулярної ділянки сітківки у хворих на ЦД 2-го типу без ДПН, при асимптоматичній А й В ДПН, симптоматичній А й В ДПН та стадії тяжких ускладнень ДПН цей показник достовірно не відрізнявся від такого у групі контролю (321,3 ± 13,0 мкм) (р > 0,05).
| Групи | Показники, мкм | Темпоральна | Верхня | Назальна | Нижня |
| Контроль, n=100 очей | M±m | 313,4 ± 12,3 | 324,7 ± 14,8 | 326,8 ± 13,3 | 320,4 ± 11,7 |
| Коливання | 301,3–338,4 | 293,8–350,7 | 296,8–348,7 | 303,7–346,9 | |
| 95% ДІ | 309,6–316,9 | 320,1–329,0 | 321,7–331,3 | 317,1–324,5 | |
| N0 стадія, n=730 очей | M±m | 311,0 ± 13,2 | 322,0 ± 15,1 | 325,5 ± 14,8 | 319,9 ± 11,8 |
| Коливання | 291,5–340,2 | 290,5–352,2 | 295,2–352,9 | 303,2–348,2 | |
| 95% ДІ | 307,3–315,7 | 317,1–327,0 | 320,2–330,4 | 315,8–325,1 | |
| N1A стадія, n=94 ока | M±m | 307,3 ± 18,6 | 320,1 ± 15,0 | 322,5 ± 14,5 | 316,4 ± 13,9 |
| Коливання | 275,8–341,9 | 286,1–351,9 | 290,3–352,9 | 289,5–348,2 | |
| 95% ДІ | 302,6–313,0 | 315,2–325,4 | 317,3–328,1 | 311,7–321,6 | |
| N1B стадія, n=108 очей | M±m | 309,9 ± 28,5 | 325,7 ± 27,4 | 327,1 ± 23,9 | 319,4 ± 22,7 |
| Коливання | 274,7–379,7 | 284,7–375,5 | 287,6–379,3 | 287,1–365,8 | |
| 95% ДІ | 300,1–320,4 | 316,4–335,1 | 319,5–336,3 | 311,9–328,3 | |
| N2A стадія, n=92 ока | M±m | 319,0 ± 29,7 | 330,3 ± 31,7 | 331,1 ± 30,5 | 327,4 ± 29,8 |
| Коливання | 259,8–368,9 | 271,4–375,8 | 281,4–366,5 | 272,3–364,8 | |
| 95% ДІ | 300,4–338,8 | 309,8–350,4 | 312,8–350,9 | 308,6–346,8 | |
| N2B стадія, n=86 очей | M±m | 318,5 ± 30,3 | 328,9 ± 32,3 | 330,4 ± 30,9 | 327,0 ± 31,4 |
| Коливання | 254,4–456,6 | 270,0–462,8 | 279,6–437,2 | 270,8–407,5 | |
| 95% ДІ | 300,4–338,8 | 309,8–350,4 | 312,8–350,9 | 308,6–346,8 | |
| N3 стадія, n=40 очей | M±m | 305,6 ± 34,3 | 318,5 ± 30,3 | 320,5 ± 31,9 | 314,7 ± 32,9 |
| Коливання | 228,9–409,4 | 260,3–412,6 | 274,6–407,3 | 249,8–389,6 | |
| 95% ДІ | 282,5–330,3 | 294,7–343,1 | 300,1–340,8 | 291,1–338,7 |
Аналізуючи показник середньої товщини комплексу ГКС у хворих з ДПН, виявили її залежність від тяжкості захворювання. Cередній показник середньої товщини комплексу ГКС при асимптоматичній А ДПН був на 8,4 %, асимптоматичній В ДПН – на 8,6 %, стадії тяжких ускладнень ДПН – на 11,0 % менше від відповідного у контрольній групі (95,8 ± 8,2 мкм) (р < 0,001). Найнижчий середній показник середньої товщини комплексу ГКС відзначили у хворих у стадії тяжких ускладнень ДПН: при симптоматичній А ДПН цей показник на 17,1 %, симптоматичній В ДПН – на 15,2 % перевищував відповідний при стадії тяжких ускладнень ДПН (р < 0,001).
Найвищий середній індекс глобальної втрати об’єму ГКС (GLV) відзначили у хворих у стадії тяжких ускладнень ДПН (рисунок 1). У хворих на ЦД без ДПН цей показник був на 68,8 %, при асимптоматичній А ДПН – на 52,2 %, при асимптоматичній В ДПН – на 50,9 %, при симптоматичній А ДПН – на 27,7 %, при симптоматичній В ДПН – на 25,9 % менше від відповідного при стадії тяжких ускладнень ДПН (р < 0,05). Найвищий середній показник FLV відзначили у хворих у стадії тяжких ускладнень ДПН (рисунок 2). У хворих на ЦД без ДПН цей показник був на 80,3 %, при асимптоматичній А ДПН – на 45,2 %, при асимптоматичній В ДПН – на 43,0 % менше від відповідного при стадії тяжких ускладнень ДПН (р < 0,05).
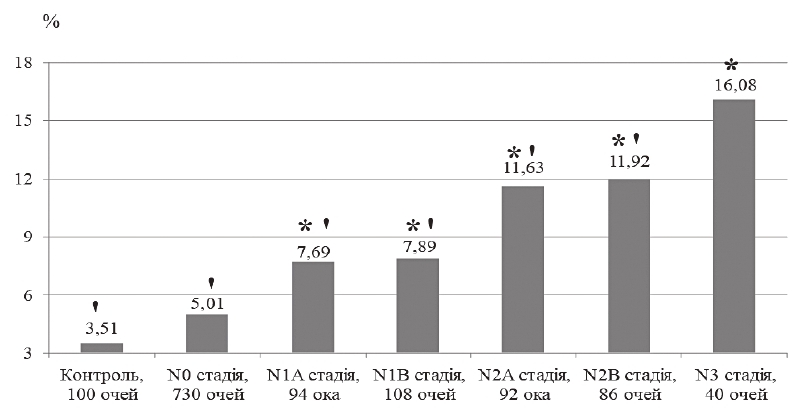
Примітка. * – достовірна відмінність між середнім значенням показника в досліджуваній і контрольній групах; ' – достовірна відмінність між середнім значенням показника у досліджуваній групі та групі хворих у N3 стадії ДПН.
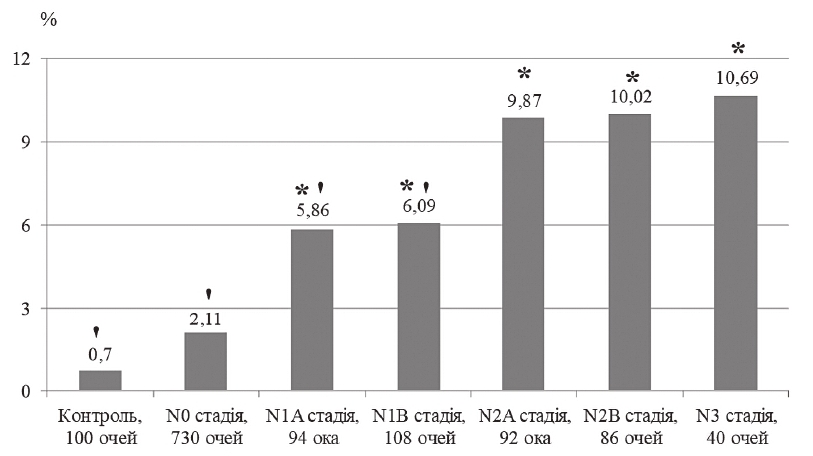
Примітка. * – достовірна відмінність між середнім значенням показника в досліджуваній і контрольній групах; ' – достовірна відмінність між середнім значенням показника у досліджуваній групі та групі хворих у N3 стадії ДПН.
Середній показник співвідношення товщини комплексу гангліонарних клітин сітківки у верхній та нижній половинах (S-I) при асимптоматичній А ДПН був у 4,4 раза, асимптоматичній В ДПН – у 5,1 раза, стадії тяжких ускладнень ДПН – у 5,9 раза менше, при симптоматичній А ДПН – в 11,8 раза, симптоматичній В ДПН – у 14 разів вище від відповідного в контрольній групі (–0,9 ± 2,2) (р < 0,001).
Отже, отримані нами дані свідчать про наявність взаємозалежності між морфометричними параметрами макули та тяжкістю діабетичної полінейропатії.
При вивченні діабетичних нейропатій було встановлено, що навіть незначне збільшення сорбітолу та фруктози в нервовій тканині призводить до зростання гіпоксії та активації процесів глікозилювання і, як наслідок, до демієлінізації нервових волокон та аксонопатії [4]. Відзначена підвищена чутливість ГКС до нейродегенеративних змін, що відбуваються при ЦД [10]. Відомо, що існують протилежні думки відносно паралельного ураження великих і малих мієлінізованих та немієлінізованих автономних нервових волокон при ЦД. Наразі доведено, що малі мієлінізовані та немієлінізовані волокна уражуються раніше, ніж великі [11]. Також встановлено взаємозв’язок між середньою та тяжкою сенсомоторною ДПН і зменшенням товщини шару перипапілярних нервових волокон сітківки у нижньому квадранті та макулі при незмінній товщині внутрішнього плексиформного шару [14–16]. Водночас Prakasam R. et al. вказують на значне стоншення внутрішніх шарів сітківки у хворих із клінічно доведеною ДПН [12]. Результати досліджень Pemp B. et al. виявили кореляцію між втратою внутрішніх шарів сітківки та послабленою автономною регуляцією при ЦД 1-го типу у хворих із непроліферативною діабетичною ретинопатією [11]. Автори інтерпретують ці зміни як відповідні ранні ознаки ретинальної та системної нейропатії при ЦД [11], що узгоджується з отриманими нами даними.
Висновки
У хворих на ЦД 2-го типу встановлено морфометричні особливості ураження макули залежно від тяжкості ДПН: індекс фокальної втрати об’єму гангліонарних клітин сітківки (FLV) при асимптоматичній А ДПН у 8,4 раза, при асимптоматичній В ДПН – у 8,7 раза, при симптоматичній А ДПН – у 14,1 раза, при симптоматичній В ДПН – у 14,3 раза, при стадії тяжких ускладнень ДПН – у 15,3 раза (р < 0,05) перевищував, а товщина сітківки у фовеолярній зоні хворих з асимптоматичною А ДПН на 9,1 %, асимптоматичною В ДПН – на 8,9 %, при стадії тяжких ускладнень ДПН – на 12,7 % була менша від показників здорових осіб відповідного віку. Виявлені морфометричні особливості макули при ЦД 2-го типу можуть слугувати неінвазивним офтальмологічним біомаркером ступеня тяжкості діабетичної полінейропатії.
СПИСОК ВИКОРИСТАНИХ ДЖЕРЕЛ
- Belova AN, Kudykin MN, Sheiko GE. [Diabetic peripheral neuropathy: epidemiology, pathogenesis, clinic, diagnostics, treatment]. I. P. Pavlov Russian Medical Biological Herald. 2016;24(4):139-151. Russian. https://doi.org/10.23888/PAVLOVJ20164139-151.
- Zaharova MA, Kuroedov AV. [Optic coherent tomography – technology which became a reality]. RMJ. Clinical ophthalmology. 2015;15(4):204-211. Russian.
- Krasavina MI, Astakhov SYu, Shadrichev FE, Dal NYu. [Ophthalmic markers of diabetic polyneuropathy]. Ophthalmology Journal. 2016;9(1):38-46. Russian. https://doi.org/10.17816/Ov9138-46.
- Levin OS. [Diabetic polyneuropathy: current approaches to diagnosis and pathogenetic therapy]. The Clinician. 2013;7(2):54-63. Russian. https://doi.org/10.17650/1818-8338-2013-7-2-221-235.
- Fokina AS, Strokov IA, Demura TA. [Diagnosis of diabetic peripherial neuropathy. Methods of its early detection]. RMJ. Neurology. 2017:9:572-578. Russian.
- Boulton AJ. Diabetic neuropathy: classification, measurement and treatment. Curr Opin Endocrinol Diabetes Obes. 2007 Apr;14(2):141-145. https://doi.org/10.1097/MED.0b013e328014979e.
- Burgess J, Frank B, Marshall A, Khalil RS, Ponirakis G, Petropoulos IN, Cuthbertson DJ, Malik RA, Alam U. Early detection of diabetic peripheral neuropathy: a focus on small nerve fibers. Diagnostics (Basel). 2021;11(2):165. https://doi.org/10.3390/diagnostics11020165.
- Carpineto P, Toto L, Aloia R, Ciciarelli V, Borrelli E, Vitacolonna E, Di Nicola M, Di Antonio L, Mastropasqua R. Neuroretinal alterations in the early stages of diabetic retinopathy in patients with type 2 diabetes mellitus. Eye (Lond). 2016 May;30(5):673-679. https://doi.org/10.1038/eye.2016.13.
- Malik RA. Diabetic neuropathy: a focus on small fibres. Diabetes Metab Res Rev. 2020 Mar;36 Suppl 1: e3255. https://doi.org/10.1002/dmrr.3255.
- Ng DS, Chiang PP, Tan G, Cheung CG, Cheng CY, Cheung CY, Wong TY, Lamoureux EL, Ikram MK. Retinal ganglion cell neuronal damage in diabetes and diabetic retinopathy. Clin Exp Ophthalmol. 2016 May;44(4):243-50. https://doi.org/10.1111/ceo.12724.
- Pemp B, Palkovits S, Howorka K, Pumprla J, Sacu S, Garhöfer G, Bayerle-Eder M, Schmetterer L, Schmidt-Erfurth U. Correlation of retinal neurodegeneration with measures of peripheral autonomic neuropathy in type 1 diabetes. Acta Ophthalmol. 2018;96(7): e804-e810. https://doi.org/10.1111/aos.13733.
- Prakasam RK, Matuszewska-Iwanicka A, Fischer DC, Schumann H, Tschöpe D, Stratmann B, Hettlich HJ, Guthoff RF, Stachs O, Röhlig M. Thickness of Intraretinal Layers in Patients with Type 2 Diabetes Mellitus Depending on a Concomitant Diabetic Neuropathy: Results of a Cross-Sectional Study Using Deviation Maps for OCT Data Analysis. Biomedicines. 2020;8(7):190. https://doi.org/10.3390/biomedicines8070190.
- Rodrigues EB, Urias MG, Penha FM, Badaró E, Novais E, Meirelles R, Farah ME. Diabetes induces changes in neuroretina before retinal vessels: a spectral-domain optical coherence tomography study. Int J Retina Vitreous. 2015 Apr 15;1:4. https://doi.org/10.1186/s40942-015-0001-z.
- Salvi L, Plateroti P, Balducci S, Bollanti L, Conti FG, Vitale M, Recupero SM, Enrici MM, Fenicia V, Pugliese G. Abnormalities of retinal ganglion cell complex at optical coherence tomography in patients with type 2 diabetes: a sign of diabetic polyneuropathy, not retinopathy. J Diabetes Complications. 2016;30(3):469-476. https://doi.org/10.1016/j.jdiacomp.2015.12.025.
- Shahidi AM, Sampson GP, Pritchard N, Edwards K, Russell A, Malik RA, Efron N. Exploring retinal and functional markers of diabetic neuropathy. Clin Exp Optom. 2010 Sep;93(5):309-323. https://doi.org/10.1111/j.1444-0938.2010.00491.x.
- Srinivasan S, Pritchard N, Sampson GP, Edwards K, Vagenas D, Russell AW, Malik RA, Efron N. Diagnostic capability of retinal thickness measures in diabetic peripheral neuropathy. J Optom. 2017 Oct-Dec;10(4):215-225. https://doi.org/10.1016/j.optom.2016.05.003.
- Wang M, Zhang C, Zuo A, Li L, Chen L, Hou X. Diagnostic utility of corneal confocal microscopy in type 2 diabetic peripheral neuropathy. J Diabetes Investig. 2021 Apr;12(4):574-582. https://doi.org/10.1111/jdi.13381.
Стаття надійшла в редакцію 08.05.2021 р. Рецензія на статтю надійшла в редакцію 24.05.2021 р.